Dr. Burak Hacıhanefioğlu
polikistikover.net internet sitesinde yer alan tıp içerikli yazı ve videoların tümü Kadın Hastalıkları ve Doğum Uzmanı Dr. Burak Hacıhanefioğlu tarafından hazırlanmış olup, telif hakları yasal koruma altına alınmıştır. İzinsiz kaynak gösterilerek dahi başka bir yerde yayınlanamaz.
Bir adet kanamasının başlangıcından itibaren takip eden adet kanamasının ilk gününe kadar geçen süre bir adet döngüsüdür (menstrual cycle). Polikistik over sendromu olan kadınların büyük bir kısmının adet döngülerinde düzensizlik vardır(1,4,5,7,8,9). Polikistik over sendromu’nda adet düzensizliği değişik şekillerde ortaya çıkmaktadır. Bu kadınlarda çoğunlukla 35 gün ile 3 ay arasında değişen aralıklarla (oligomenorrhea) adet kanamaları (2,4,7,8,9). Daha küçük bir kısmında ise 3 aydan daha uzun aralıklarla (amenorrhea) adet kanamaları görülmektedir(2,5,7,8,,9). Polikistik over senmu olan kadınların bir bölümünde ise adet düzensizliği yoktur. Adet düzensizliği olmayanlarda adet kanamaları 21 ila 35 günde bir (eumenorrhea) olmaktadır(2,3,6,9). Lekelenme şeklinde az miktarda veya fazla miktarda, koyu renkli, pıhtılı uzun süre devam eden adet kanamaları (menometrorrhagia) polikistik over sendromu olan kadınların bir kısmında ortaya çıkmaktadır(1,2,5,7,8,9). kaınlrın bir bölümünde adet kanamalarının 21 günden daha sık aralıklarla olduğu (polymenorrhea) da görülmektedir (1,5,7,8,9).
Polikistik over sendromu olan kadınların bir kısmında 35 ila 90 günde bir görülen bir kaç adet kanamasını 21 ila 35 günde bir görülen düzenli adet kanamaları takip etmekte ve bir süre sonra aynı kadında adet kanamaları tekrar 35 ila 90 günde bir görülmeye devam etmektedir(6,25).
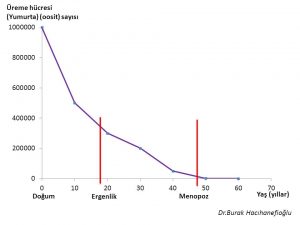
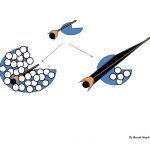
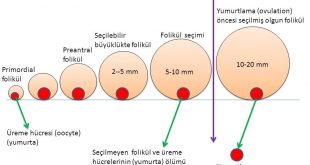
Gebeliğin 20. haftasında fetus yumurtalıklarında yaklaşık 7 milyon üreme hücresi (oocyte) vardır(14,15,16,19). Hızlı bir şekilde öldükleri (atresia) (apoptosis) için doğumda yaklaşık 1 milyon üreme hücresi kalmaktadır(14,15,16,17,19). Ergenlik döneminin başında üreme hücresi sayısı 400 bin civarına inmektedir. Ergenlik döneminden itibaren menopoz dönemine kadar her adet döngüsünde (menstrual cycle) yumurtlama (ovulation) için bir yumurta kullanılmaktadır(14,15,18). Ergenlik döneminden itibaren menopoz dönemine kadar yumurtlamanın olduğu adet döngülerinin (menstrual cycle) toplamında yaklaşık 400 tane yumurta kullanılmaktadır(14,15,18,19,20). Bir yumurtlamanın olduğu her adet döngüsünde 1000 tane yumurta da ölmektedir (atresia) (apoptosis)(14,15,18,19,20). Bunun sonucunda menopoz öncesi dönemde yumurta sayısı 1000 civarına kadar inmekte ve bir süre sonra menopoz döneminde de bitmektedir(14,15,18,19).
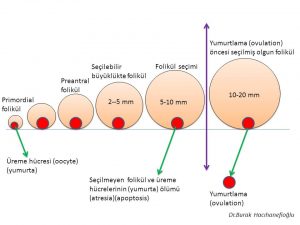
Bir adet döngüsünde (menstrual cycle) üreme hücresini (oosit) içinde taşıyan küçük foliküllerden (antral) (5-10 mm) bir tanesi seçildikten sonra yumurtlama öncesi olgun folikül (dominant) (20 mm) halini almaktadır(10,11,12,13,35,37). Yumurtlama (ovulasyon) bu folikül içinden üreme hücresinin (oosit) dışarıya çıkmasıyla oluşmaktadır(10,11,12,13).
1-Polikistik over sendromu olan kadınlarda üreme hücrelerini (oocyte) içinde taşıyan dinlenme aşamasında bulunan en küçük foliküllerde (resting follicles) (primordial folikül) hızlı bir büyüme görülmektedir(21,22). Hızlı büyüyen bu küçük foliküllerin ölüm (atresia) (apoptosis) oranları da düşük olup canlılıklarını (survival) sürdürmektedirler(23,26,27). Bunun sonucunda folikül seçimi (5-10 mm) öncesinde bulunan ve daha küçük (< 2 mm) (preantal) foliküllerin sayısı artmaktadır(21,22,23,24). 2-Polikistik over sendromu olan kadınlarda folikül seçimi aşamasına (5-10 mm) gelmiş foliküllerden bir tanesi seçilerek daha ileri aşamaya geçememektedir (arrested follicles). Bunun sonucunda yumurtlama (ovulation) öncesi (preovulatory) olgunluğa ulaşmış bir folikül (dominant) oluşmamaktadır(28,29,30,31).Polikistik over sendromu olan veya olmayan kadınlarda yumurtlama (ovulation) meydana geldikten yaklaşık 14 gün sonra adet kanaması (menstruation) başlamaktadır. Polikistik over sendromu’nda adet döngüsünde ( menstrual cycle) görülen düzensizliğin nedeni, seçilmiş bir folikülün gelişip yumurtlama (ovulation) öncesi olgun folikül (preovulatory) (dominant) aşamasına ulaşmasının uzun zaman alması (oligo-ovulation) ya da hiç ulaşmamasıdır (anovulation) (28,29,30,31).
Adet kanamaları 21 ila 35 gün arasında değişen aralıklarla (eumenorrhea) düzenli olan kadınlarda yumurtlama (ovulation) öncesi (preovulatory) olgunluğa ulaşmış bir folikülün (dominant) oluştuğu ve bunu takiben yumurtlamanın (ovulation) meydana geldiği kabul edilmektedir (10,35,36,37). Fakat, kadınların küçük bir kısmında ise 21 ila 35 gün arasında (eumenorrhea) düzenli adet kanamaları olmasına rağmen yumurtlama (ovulation) öncesi olgun folikül (preovulatory) (dominant) ve takiben yumurtalama (ovulation) olmamaktadır (32). 21 ila 35 gün arasında (eumenorrhea) düzenli adet kanamaları olmasına rağmen yumurtlama (ovulation) olmayanların oranı polikistik over sendromu olan kadınlarda çok daha fazladır (2).
Erkeklik hormonlarının (testosteron, dihidrotestosteron) miktarındaki artışa (hyperandrogenism) bağlı tüylenme artışı, sivilce ve saç dökülmesi görülen kadınların bir kısmında 21 ila 35 günde bir (eumenorrhea) düzenli adet kanamaları olmasına rağmen bunların yaklaşık yarısı olgun folikül (preovulatory) (dominant) gelişmediği için yumurtlama (ovulation) olmadan meydana gelmektedir (2,33,34).
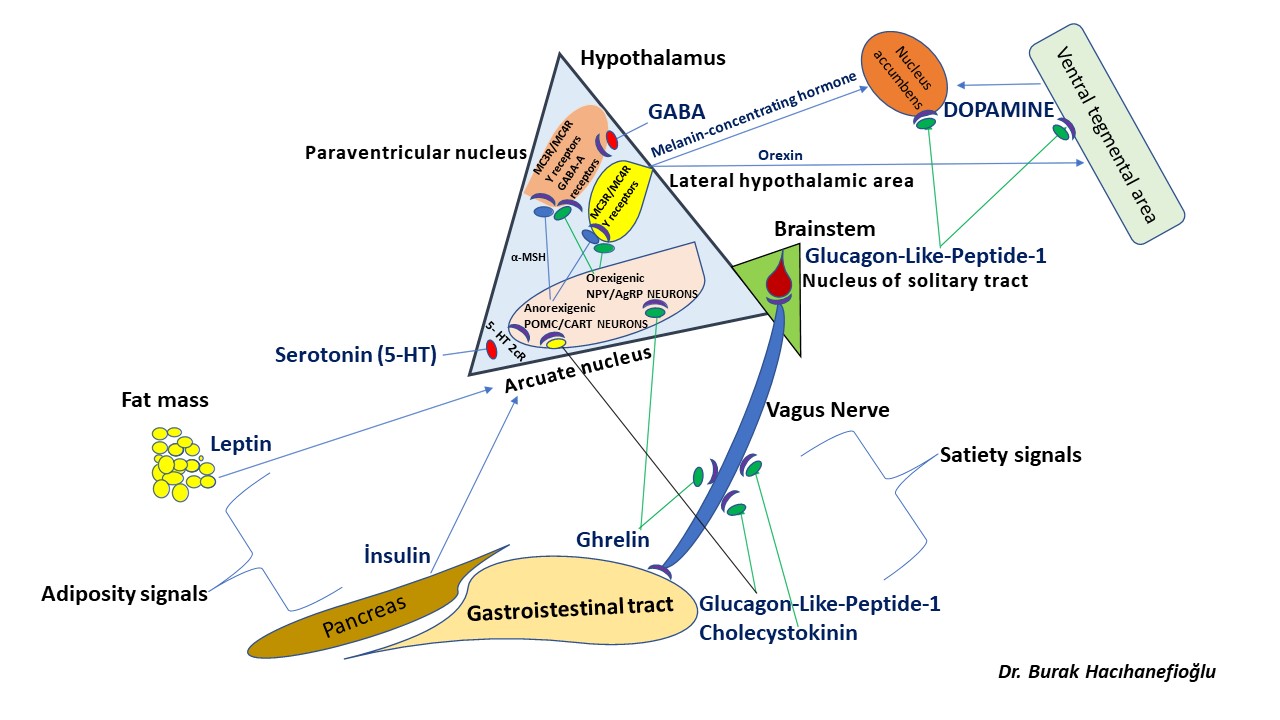
Polikistik over sendromu’nda fazla kilolu ve şişman olan veya normal kilolu fakat bel çevresi kalın (erkek tipi yağlanma) olan kadınların büyük çoğunluğunda insülin direnci görülmektedir(139,140,141,142). İnsülin direnci nedeniyle kan dolaşımında fazla miktarda bulunan insülin hormonu polikistik over sendromu olan kadınların bir kısmında hem doğrudan yumurtalığa giderek hem de hipofiz bezinde LH (luteinizing hormon) üretimini arttırarak olgun folikül (preovulatory) (dominant) oluşumunu ve takiben yumurtlamayı (ovulation) engellemektedir(30,137). Bunun sonucunda adet kanamaları 35 gün ile 3 ay arasında değişen aralıklarla (oligomenorrhea) veya 3 aydan daha uzun aralıklarla (amenorrhea) olanlarda adet kanamaları 21 ila 35 günde bir (eumenorrhea) olanlara göre insülin direnci ve şeker hastalığı (diabetes mellitus ) daha sık görülmektedir(2,143,144,145,146). Adet kanamalarının görülme aralıkları uzadıkça insülin direncinin şiddeti de artmaktadır(2,145,146).
Üreme hücrelerini (oocyte) içinde taşıyan foliküllerde (granulosa ve theca hücreleri) insülin hormonu alıcıları (receptors) bulunmaktadır(147,148,149,150,151,152).
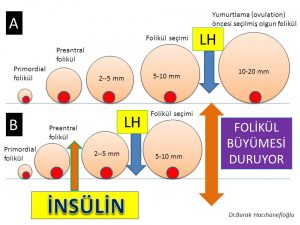
Polikistik over sendromu olan kadınların bir kısmında insülin direncine bağlı fazla miktarda üretilen insülin (hiperinsülinemi) hormonu ile fazla miktarda üretilen LH (luteinizing hormon) alıcılara (receptors) tutunarak folikül seçimi aşamasına (5- 10 mm) gelmiş foliküllerin yumurtlama (ovulation) öncesi (preovulatory) olgun folikül (dominant) aşamasına ulaşmadan erken dönemde büyümesinin durmasına (premature arrest) neden olmaktadır(28,29,138,149,150,151,152). Bu nedenle folikül seçimi aşamasına (5-10 mm) gelmiş foliküllerden bir tanesi seçilerek daha ileri aşamaya geçememektedir (arrested follicles). Bunun sonucunda da yumurtlama olmamaktadır (anovulasyon)(28,29,151).
Erkeklik hormonları (androgens) yumurtalıklarda en küçük foliküllerin (primordial) büyümesiyle (initiation) oluşan küçük foliküllerden (preantral) itibaren yumurtlama öncesi olgun folikül (preovulatory) aşamasına kadar hatta yumurtlama sonrasında bile folikülü oluşturan hücrelerde (granulosa, theca, oocyte) bulunan alıcılara (receptors) tutunarak etkili olmaktadır(156,157,159,160,163).
Üreme hücrelerini (oocyte) içinde taşıyan dinlenme aşamasında bulunan en küçük foliküllerin (resting follicles) (primordial folikül) büyümeye başlaması ve bu foliküllerin ölmeden (atresia) (apoptosis) canlılıklarını (survival) sürdürebilmesi için belirli miktarlarda erkeklik hormonlarına (androgens) ihtiyaçları vardır(54,154,155).
Kadınlarda 30′ lu ve 40′ lı yaşlardan sonra erkeklik hormonlarının miktarları azalmaktadır(133,153). Menopoz öncesi dönemde yumurta sayısının azalması ile birlikte erkeklik hormonları (testosteron, dihidrotestosteron) da azaldığı için kendiliğinden (spontaneous) gebe kalınması zorlaşmaktadır(158). Hatta 30′ lu ve 40′ lı yaşlardan sonra erkeklik hormonlarının azalması çocuk isteği tedavisi nedeniyle yumurta (oocyte) taşıyan folikülleri büyütmek için kullanılan ilaçların etkisini azaltmaktadır(158,164).
5- α reduktaz (reductase) enzimi yumurtalıklarda yumurtaları (oocytes) içinde taşıyan folikülleri oluşturan hücrelerde (granulosa, theca) bulunmaktadır(165,166). 5- α reduktaz (reductase) enzimi testosteron hormonunu 10 kat daha güçlü bir etkiye sahip olan dihidrotestosteron (dhydrotestosterone) hormonuna dönüştürmektedir(167,168,169). Polikistik over sendromu olan kadınların yumurtalıklarında 5- α reduktaz (reductase) enziminin etkinliği (activity) polikistik over sendromu olmayanlardan çok daha fazla olup daha fazla miktarda dihidrotestosteron üretmektedir(166).
Böbrek üstü bezinde fazla miktarda erkeklik hormonu üretilen kadınlarda (congenital adrenal hyperplasia) ve kadından erkeğe cinsiyet değişikliği (female-to-male transsexulas) amacıyla erkeklik hormonu kullananlarda polikistik over sendromu’nda olduğu gibi üreme hücrelerini (oocyte) içinde taşıyan dinlenme aşamasında bulunan en küçük foliküllerde (resting follicles) (primordial folikül) hızlı bir büyüme görülmektedir(161,162). Bunun sonucunda folikül seçimi (5-10 mm) öncesinde bulunan ve daha küçük (< 2 mm) (preantal) foliküllerin sayısı artmaktadır. Fakat, folikül seçimi aşamasına (5-10 mm) gelmiş foliküllerden bir tanesi seçilerek daha ileri aşamaya geçememektedir (arrested follicles)(161,162).
Kadınlarda erkeklik hormonlarının (androgens) fazlalığı (hyperandrogenism) da azlığı (hypoandrogenism) da yumurta gelişimini (folliculogenesis) ve yumurtlamayı (ovulation) engellediği için adet düzensizliği ile birlikte gebe kalmayı da zorlaştırmaktadır.
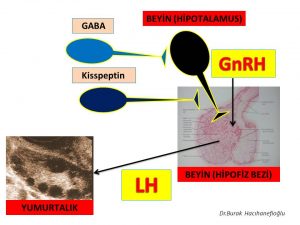
Polikistik over sendromu olan kadınların bir kısmında GnRH hormonu salgılayan jeneratörün (dinamo) fazla çalışmasına (hyperactive) neden olan beyinde daha üst seviyelerde bulunan sinir hücreleri (neurons) vardır(56,58,59,63,64,65,66). Bu sinir hücrelerinden GABA ve Kisspeptin (neurotransmitters) salgılanmaktadır. Kisspeptin salgılayan sinir hücrelerinin bir kısmından Neurokinin B (NKB) ve Dynorphin (neurotransmitters) de salgılanmaktadır(66,67,69,70,71,72,73). Bu maddeler (neurotransmitters) polikistik over sendromu olan kadınlarda hipofiz bezinde üretilen LH hormonu miktarı ile birlikte salgılanma zamanının sıklığını (frequency) da arttırmaktadır(56,57,58,59,60,61,62,63,64,65,66,67,68,69,70).
Polikistik over sendromu olan kadınların bir kısmında erkeklik hormonlarının (testosteron, dihidrotestosteron) fazla miktarda üretilmesi (hyperandrogenism) ve insülin direncine bağlı insülin miktarının artması (hyperinsulinemia) beyinde GnRH hormonu salgılayan jeneratörün (dinamo) fazla çalışmasına (hyperactive) neden olmaktadır(58,63,74,75). Erkeklik hormonları (testosteron, dihidrotestosteron) ve insülin bunu GnRH (Gonadotropin-releasing hormone) salgılayan sinir hücrelerinden (neurons) daha üst seviyelerdeki sinir hücrelerinde üretilen GABA ve Kisspeptin (neurotransmitters) salgılanmasını etkileyerek yapmaktadır(38,63,74,75).
Beyinde belirli aralıklarla (pulsatile) GnRH hormonu salgılayan jeneratör (dinamo) ergenlik (puberte) öncesi dönemde GnRH hormonunu daha çok uyku sırasında salgılamaktadır(76,77,78). GnRH hormonu salgılanmasında gün içinde (day-time) artış olurken uyku sırasında azalma olmasıyla birlikte ergenlik (puberte) dönemi başlamaktadır(76,77,78).
Yumurtalıklarda yapılan östrojen (estrogen) hormonu miktarının artması hipotalamus tarafından GnRH hormonunun belirli aralıklarla (pulsatile) salgılanması sonucunda hipofiz bezinde üretilen LH hormonu miktarında belirli (surge) bir artışa (positive feedback) neden olmaktadır(10,52). LH artışını (surge) takiben yumurtlama (ovulasyon) olmaktadır(10,52).
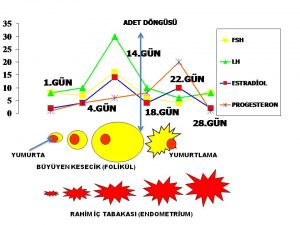
Ergenlik (puberte) döneminde henüz hipotalamus, hipofiz ve yumurtalık arasındaki iletişim tam olarak gelişmediği (immature) için yumurtlama olmamasına (anovulasyon) bağlı olarak ilk adet kanamasını (menarche) takip eden yıllarda ergenlik döneminde bulunan kızların büyük bir kısmında değişik şekillerde adet düzensizliği görülmektedir(6,79,80,81,82,83,84,85,86,111,112,113,114).
Ergenlik döneminde (puberte) çoğunlukla 35 günden daha uzun aralıklarla (oligomenorrhea) adet kanamaları görülürken bunların bir kısmında da 6 aydan daha uzun aralıklarla (secondary amenorrhea) adet kanamaları görülmektedir(85,87,88). Ergenlik döneminde bulunan kızların küçük bir bölümünde yumurtlama (ovulasyon) olmamasına rağmen adet kanamaları 21 ila 35 günde bir (eumenorrhea) düzenli olmaktadır(89,90,91). Hatta bu kızların bir bölümünde adet kanamaları 21 günden daha sık aralıklarla (polymenorrhea) olmaktadır(89,90,91,92).
Ergenlik döneminde yumurtlama (ovulasyon) olmaması nedeniyle adet kanamaları düzensiz olan kızlarda ilk adet kanamasını (menarche) takip eden yıllar içinde giderek artan sıklıkta yumurtlamanın (ovulasyon) olduğu adet kanamaları olmaya başlamaktadır(77,82,83). İlk adet kanamasını (menarche) takip eden 5 yıl sonunda bu kızların büyük çoğunluğunda (%80) yumurtlamanın (ovulasyon) olduğu düzenli adet kanamaları görülmektedir(82,83,93). İlk adet kanamasını takip eden 5 yılın sonunda hala 21 ila 35 günde bir (eumenorrhea) düzenli adet kanamaları görülmeyenlerde (%20) adet düzensizliği ileri yaşlara hatta 30 lu 40 lı yaşlara kadar devam etmektedir(77,83,89,93,94,95). İlk adet kanamasını (menarche) takip eden 2 yıl sonunda 35 günden daha uzun aralıklarla (oligomenorrhea) veya 6 aydan daha uzun aralıklarla (secondary amenorrhea) adet kanamaları görülen kızların yarısında polikistik over senromu vardır(77,83,89,93,94,95). İlk adet kanamasını (menarche) takip eden 2 yıl sonunda adet kanamaları 35 günden daha uzun aralıklarla (oligomenorrhea) olmaya devam eden bu kızların büyük bir kısmında LH (luteinizing hormon) ve erkeklik hormonları (testosteron, dihidrotestosteron) kan dolaşımında fazla miktarlarda bulunmaktadır(88,102,103,104,105,106,107,108,109,110).
İlk adet kanamasını (menarche) takip eden 2 yıl sonunda 35 günden daha uzun aralıklarla (oligomenorrhea) veya 6 aydan daha uzun aralıklarla (secondary amenorrhea) adet kanamaları olan kızların bir kısmında psikolojik kaynaklı yemek yeme bozuklukları (eating disorders) görülmektedir(115,116,181). Karbonhidrat içerikli besinlerin tüketiminin kesilmesi sonucunda oluşan açlık (starvation) ile birlikte kilo kaybedilmesi (Anorexia Nervosa) 6 aydan daha uzun aralıklarla (secondary amenorrhea) adet kanamaları olan kızlarda daha sık görülmektedir(90,91,117,118,170). Anorexia Nervosa’ ya bağlı oluşan kilo kaybı nedeniyle beyinde hipotalamus bölgesinde bulunan jeneratörden (dinamo) GnRH hormonu salgılanması engellenmektedir (Inhibition). Bunun sonucunda hipofiz bezinden salgılanan FSH ve LH miktarlarının azalması yumurtalıklarda östrojen (estrogen) üretimini azaltarak 6 aydan daha uzun aralıklarla (secondary amenorrhea) adet kanamalarına (hypothalamic amenorhea) neden olmaktadır(119,170).
Polikistik over sendromu nedeniyle kan dolaşımında fazla miktarlarda LH (luteinizing hormon) ve insülin bulunan 35 günden daha uzun aralıklarla (oligomenorrhea) adet kanamaları olan bir kız aşırı kilo kaybı yaşadığı taktirde Polikistik over sendromu’ndan LH (luteinizing hormon) ve insülin miktarlarının azaldığı Anorexia Nervosa’ ya geçiş gösterebilir. Bu durumda adet kanamaları da tamamen kesilebilir (secondary amenorrhea).
Aşırı yemek yeme atakları sonrasında kilo alımını engellemek için kusma yöntemi veya ishal yapıcı ilaçların (laxatives) kullanılması (Bulimia Nervosa) ya da aşırı yemek yemesine rağmen doyma hissini kaybettiği atakların olması (Binge eating) çoğunlukla adet kanamaları 35 gün ila 3 ayda bir (oligomenorrhea) olan kızlarda görülmektedir(120,121,122,123,124,180,181).
Açlık (starvation) nedeniyle kilo kaybedilmesi (Anorexia Nervosa) şeklinde olan yemek yeme bozukluğu 6 aydan daha uzun aralıklarla (secondary amenorrhea) adet kanamaları olan kızlarda daha sık görülürken, polikistik over sendromu’na bağlı erkeklik hormonlarının artması (hyperandrogenism) ile birlikte adet kanamaları 35 gün ila 3 ayda bir (oligomenorrhea) olan kızlarda yemek yeme bozukluğu daha çok aşırı yemek yeme atakları sonrasında kilo alımını engellemek için kusma yöntemi veya ishal yapıcı ilaçların (laxatives) kullanılması (Bulimia Nervosa) ya da aşırı yemek yemesine rağmen doyma hissini kaybettiği ataklar (Binge eating) şeklinde görülmektedir. Aşırı yemek yeme isteği atakları (Food cravings) çok beğenilen bir çeşit yiyecek veya içecek için olmakta olup genellikle bunlar da yüksek enerji (kalori) içeren yağlı, şekerli ve fast-food besinler olmaktadır.
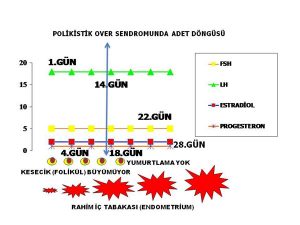
Polikistik over sendromu olan kızlarda ilk adet kanamasının (menarche) görülme zamanında da farklılıklar vardır(4,96,97,98,99). Bu kızların bir kısmında ilk adet kanaması (menarche) öncesi folikül seçimi aşamasına (5-10 mm) gelmiş foliküllerden bir tanesi seçilerek daha ileri aşamaya geçememektedir (arrested follicles). Bunun sonucunda yumurtlama (ovulation) öncesi (preovulatory) olgunluğa ulaşmış bir folikül (dominant) oluşmadığı için ilk adet kanaması (menarche) gecikerek 16 yaşından sonra olmaktadır (primary amenorrhea) (28,29,30,31). Polikistik over sendromu olan ve 2500 gram’ dan daha düşük doğum ağırlığı ile doğan kızların bir kısmında genital bölge (pubis) kıllanması 8 yaşından önce (premature pubarche) ortaya çıkmaktadır(100,101). Polikistik over sendromu olan bu kızlarda da ilk adet kanaması (menarche) diğer kızlara göre daha erken yaşlarda görülmektedir(96,98). Polikistik over sendromu olan kızların fazla kilolu veya şişman olanlarında da ilk adet kanaması (menarche) daha erken yaşlarda olmaktadır(4,97,98,99).
Polikistik over sendromu’ndan kaynaklanan adet düzensizliğinin ergenlik döneminde görülen normal (fizyolojik) kabul edilen adet düzensizliğinden ayırt edilmesi polikistik over sendromu’nun erken teşhis edilmesini ve ilerlemeden önlenmesini sağlamaktadır.
Polikistik over sendromu olan kadınların bir kısmında seçilmiş bir folikülün gelişip yumurtlama (ovulation) öncesi olgun folikül (preovulatory) (dominant) aşamasına ulaşmasının uzun zaman alması (oligo-ovulation) ya da hiç ulaşmaması (anovulation) nedeniyle adet kanamaları gecikmekte (oligomenorrhea) ya da hiç olmamaktadır (amenorrhea) (28,29,30,31). Bu kadınlarda insülin direnci, bozulmuş şeker toleransı ve şeker hastalığı ve bunun sonucunda da metabolik sendrom ergenlik döneminden itibaren genç yaşlarda (< 40 yaş) polikistik over sendromu olmayan kadınlara göre daha sık görülmektedir (125,126,127,128,129,130,131,132).
Polikistik over sendromu’nun etkisi ve şiddeti 30 lu yaşlardan itibaren 40 lı yaşları takiben ve menopoz sonrası dönemde gittikçe azalmaktadır. Polikistik over sendromu olan kadınlarda fazla olan erkeklik hormonlarının miktarları (hiperandrogenism) yaş ilerledikçe 20 li yaşlardan itibaren özellikle 40 lı yaşları takiben azalmaktadır(132,133). Fazla sayıda olan yumurta (antral folikül) sayısının azalmasına bağlı olarak da yaş ilerledikçe bu kadınların adet kanamaları daha düzenli (eumenorrhea) olmaya başlamakta ve hatta 30 lu yaşların ortalarından itibaren bu kadınlar daha kolay gebe kalabilmektedirler(133,134,135,136,137).
Tedavi;
Yumurtalıklarda erkeklik hormonu (androgen) üretimini arttıran beyinde bulunan GnRH hormonu salgılayan jeneratörün (dinamo) artmış olan etkinliğinin (activity) azaltılması, erkeklik hormonlarının yumurtalıklarda (ovaries) artmış olan üretiminin ve etkinliğinin azaltılması ve erkeklik hormonlarına bağlanarak onları etkisiz hale getiren Sex hormon Binding Globulin (SHBG) miktarının arttırılması sonucunda yumurtayı içinde taşıyan küçük keseciğin (folikül) büyümesi (folliculogenesis) ve yumurtlamanın (ovulation) sağlanması tedavinin temel amacıdır.
Polikistik over sendromu’nda adet düzensizliği tedavisinde doğum kontrol hapı kullanılması doğru değildir.
Doğum kontrol hapları polikistik over sendromu’nu tedavi etmemektedir. Bu haplarla meydana gelen adet kanaması yumurta gelişimi (folliculogenesis) ve yumurtlama (ovulation) olmadan oluşmaktadır. Bu nedenle bu kanama gerçek bir adet kanaması değildir. Doğum kontrol hapları adet düzensizliğini tedavi etmemekle birlikte bir çok yan etkiye de neden olabilmektedir.
Uzun etkili ve kalıcı bir tedavi etkinliğinin olmamasına ve bacak damarlarının pıhtı ile tıkanması (derin ven trombozu) ve ordan kopan pıhtı parçasının da akciğer damarlarını tıkaması (pulmoner emboli) ve meme kanseri ihtimalini arttırması gibi bir kısmı hayati tehlikeye sahip olan bir çok yan etkiye sahip olmasına rağmen doğum kontrol hapları adet düzensizliği tedavisinde halen yaygın olarak kullanılmaktadır(171,172,173,174,175,176,177,178).
Polikistik over sendromu olan kadınların bir kısmında yumurta gelişimi süresinde ve yumurtlama zamanında ve bunun sonucunda da adet düzeninde yıllar içinde değişiklikler olmaktadır. Bu durum düzenli adet görmek için doğum kontrol hapı kullanan kadınların doğum kontrol hapı kullanmasına gerek olmadan düzenli adet görebilecek iken adet düzensizliğinin devam ettiğini zannederek gereksiz yere uzun yıllar doğum kontrol hapı kullanmasına neden olmaktadır.
Tedavi Yöntemleri;
1-GnRH hormonu salgılayan jeneratörün (dinamo) beyinde fazla çalışmasına (hyperactive) bağlı olarak GnRH hormonunun belirli aralıklarla (pulsatile) salgılanma sıklığında görülen artışın engellenmesi ile hipofiz bezinde LH hormonunun üretim sıklığı (frequency) ve kan dolaşımında bulunan (basal) miktarının azaltılması bir tedavi seçeneğidir(38,42,43,44,45,46,47,51,55). Beyinde daha üst seviyelerde bulunan sinir hücrelerinden salgılanan GABA, Kisspeptin, Neurokinin B (NKB) ve Dynorphin (neurotransmitters) GnRH hormonu salgılayan jeneratörün (dinamo) fazla çalışmasına (hyperactive) neden olmaktadır(56,57,58,59,60,61,62,63,64,65,66,67,68,69,70,71,72,73). Bunların GnRH hormonu salgılayan jeneratöre olan etkilerinin engellenmesi (antagonist) sonucunda erkeklik hormonlarının yumurtalıkta yapılmasını sağlayan LH (luteinizing hormon) miktarının azalması yumurtalıklarda fazla miktarlarda üretilen erkeklik hormonlarını (hiperandrogenism) azaltmakla birlikte yumurtlama öncesi olgun folikül (dominant) gelişimini ve yumurtlamayı (ovulasyon) da sağlamaktadır(69,70,71,179). 2-İnsülin direncine bağlı insülin miktarının artması (hyperinsulinemia) beyinde GnRH hormonu salgılayan jeneratörün (dinamo) fazla çalışmasına (hyperactive) neden olmaktadır(58,63,74,75). İnsülin direncine bağlı fazla miktarda üretilen insülin (hiperinsülinemi) hormonu ile fazla miktarda üretilen LH (luteinizing hormon) hormonu birlikte (synergistic) alıcılara (receptors) tutunarak folikül seçimi aşamasına (5- 10 mm) gelmiş foliküllerin yumurtlama (ovulation) öncesi (preovulatory) olgun folikül (dominant) aşamasına ulaşmadan erken dönemde büyümesinin durmasına (premature arrest) neden olmaktadır(28,29,138,149,150,151,152). İnsülin direncine bağlı insülin miktarının artması aynı zamanda karaciğerde üretilen SHBG miktarını azaltarak erkeklik hormonlarının serbest dolaşan etkin formlarının (serbest testosteron) artmasına neden olmaktadır(182,183). Bu nedenlerden dolayı insülin direnci olan kadınlarda insülin duyarlılığının ilaç tedavisi ile arttırılmasına bağlı olarak kan dolaşımında bulunan insülin miktarının azaltılması bir tedavi seçeneğidir(202,203). 3-Erkeklik hormonları yumurtalıklarda alıcılara (androgen receptor) tutunarak folikül seçimi (5-10 mm) öncesinde bulunan ve daha küçük (< 2 mm) (preantal) foliküllerin sayısını arttırmaktadır. Bunu takiben de folikül seçimi aşamasına (5-10 mm) gelmiş foliküllerden bir tanesinin seçilerek daha ileri aşamaya ulaşamamasına (arrested follicles) neden olmaktadır(28,29,151). Erkeklik hormonları beyinde GnRH hormonu salgılayan jeneratörün daha üst seviyelerinde bulunan alıcılara tutunarak GnRH hormonu salgılayan jenaratörün fazla çalışmasına (hyperactivity) neden olmaktadır(74). Bu nedenlerle erkeklik hormonlarının alıcılara tutunmasının engellenmesi (androgen receptor antagonist) diğer bir tedavi seçeneğidir(74,184,185,186,187,188,189,191,192,193,194). Bu amaçla kullanılan ilaçların (androgen receptor antagonists) doğum kontrol hapları gibi hayati tehlikeye sahip yan etkileri (bacak damarlarının pıhtı ile tıkanması ve ordan kopan pıhtı parçasının da akciğer damarlarını tıkaması ve meme kanseri) yoktur(192,195,196,197). 4-Testosteron hormonu 5- α reduktaz (reductase) enzimi tarafından yumurtalıklarda 10 kat daha fazla etkiye sahip olan dihidrotestosteron (dhydrotestosterone) hormonuna dönüşmektedir(165,166,167,168,169). 5- α reduktaz (reductase) enziminin bu etkisinin engellenmesi (5- α reductase inhibitor) de bir tedavi seçeneğidir(165,166,167,168,169,190). Bu amaçla kullanılan ilaçların (5-α reductase inhibitors) doğum kontrol hapları gibi hayati tehlikeye sahip yan etkileri (bacak damarlarının pıhtı ile tıkanması ve ordan kopan pıhtı parçasının da akciğer damarlarını tıkaması ve meme kanseri) yoktur(198).
∗Yukarıda anlattığım tedavi seçeneklerinden hangisinin uygulanacağı başka şikayetlerin (saç dökülmesi, sivilce, tüylenme artışı) birlikteliğine bağlı olarak kişiden kişiye göre değişmektedir. Çoğunlukla birden fazla tedavi seçeneği birlikte uygulanmaktadır.
Kaynaklar
1-Clinical and bichemical features of polycystic ovarian disease. Goldzieher JW, Axelrod LR. Fertil Steril. 1963 Nov-Dec;14:631-53. 2-The severity of menstrual dysfunction as a predictor of insulin resistance in PCOS. Brower M, Brennan K, Pall M, Azziz R. J Clin Endocrinol Metab. 2013 Dec;98(12):E1967-71. 3-The Androgen Excess and PCOS Society criteria for the polycystic ovary syndrome: the complete task force report. Azziz R, Carmina E, Dewailly D, Diamanti-Kandarakis E, Escobar-Morreale HF, Futterweit W, Janssen OE, Legro RS, Norman RJ,Taylor AE, Witchel SF; Task Force on the Phenotype of the Polycystic Ovary Syndrome of The Androgen Excess and PCOS Society. Fertil Steril. 2009 Feb;91(2):456-88. 4-Women with polycystic ovary syndrome wedge resected in 1956 to 1965: a long-term follow-up focusing on natural history and circulating hormones. Dahlgren E, Johansson S, Lindstedt G, Knutsson F, Odén A, Janson PO, Mattson LA, Crona N, Lundberg PA. Fertil Steril. 1992 Mar;57(3):505-13. 5-Amenorrhea associated with bilateral polycystic ovaries. Stein IF, Leventhal ML. Am J Obstet Gynecol. 1935, 29(2):181-191. 6-Variation of the human menstrual cycle through reproductive life. Treloar AE, Boynton RE, Behn BG, Brown BW. Int J Fertil. 1967 Jan-Mar;12(1 Pt 2):77-126. 7-Polycystic ovary syndrome: the spectrum of the disorder in 1741 patients. Balen AH, Conway GS, Kaltsas G, TechatrasakK, Manning PJ, West C, Jacobs HS. Hum Reprod. 1995 Aug;10(8):2107-11. 8-Heterogeneity of the polycystic ovary syndrome: clinical, endocrine and ultrasound features in 556 patients. Conway GS, Honour JW, Jacobs HS. Clin Endocrinol (Oxf). 1989 Apr;30(4):459-70. 9-Androgen excess in women: experience with over 1000 consecutive patients. Azziz R, Sanchez LA, Knochenhauer ES, Moran C, Lazenby J, Stephens KC, Taylor K, Boots LR. J Clin Endocrinol Metab. 2004 Feb;89(2):453-62. 10-Regulation of ovarian follicular development in primates: facts and hypotheses. Gougeon A . Endocr Rev. 1996 Apr;17(2):121-55. 11-The microenvironment of the human antral follicle: interrelationships among the steroid levels in antral fluid, the population of granulosa cells, and the status of the oocyte in vivo and in vitro. Mc Natty KP, Smith DM, Makris A, Osathanondh R, Ryan KJ. J Clin Endocrinol Metab. 1979 Dec;49(6):851-60. 12-Morphological and endocrinological studies on follicular development during the human menstrual cycle. Chikazawa K, Araki S, Tamada T. J Clin Endocrinol Metab. 1986 Feb; 62(2):305-13. 13-Aspects of ovarian follicle development throughout life. Macklon NS, Fauser BC. Horm Res. 1999;52(4):161-70. 14-Oocyte apoptosis: like sand through an hourglass. Morita Y, Tilly JL. Dev Biol. 1999 Sep 1;213(1):1-17. 15-Ovarian follicle atresia: a hormonally controlled apoptotic process. Hsueh AJ, Billig H, Tsafriri A. Endocr Rev. 1994 Dec;15(6):707-24. 16-Morphometric study of the human neonatal ovary. Forabosco A, Sforza C, De Pol A, Vizzotto L, Marzona L, Ferrario VF. Anat Rec. 1991 Oct;231(2):201-8. 17-Follicular atresia in the infant human ovary. Himelstein-Braw R, Byskov AG, Peters H, Faber M. J Reprod Fertil. 1976 Jan;46(1):55-9. 18-Age-related changes of the population of human ovarian follicles: increase in the disappearance rate of non-growing and early-growing follicles in aging women. Gougeon A, Ecochard R, Thalabard JC. Biol Reprod. 1994 Mar;50(3):653-63. 19-Accelerated disappearance of ovarian follicles in mid-life: implications for forecasting menopause. Faddy MJ, Gosden RG, Gougeon A, Richardson SJ, Nelson JF. Hum Reprod. 1992 Nov;7(10):1342-6. 20-Biological and clinical importance of ovarian cell death. Tilly JL, Ratts VS. Contemp Ob Gyn. 1996 March:59-86. 21-Morphology and morphogenesis of the Stein-Leventhal ovary and of so-called “hyperthecosis”. Hughesdon PE. Obstet Gynecol Surv. 1982 Feb;37(2):59-77. 22-Abnormal preantral folliculogenesis in polycystic ovaries is associated with increased granulosa cell division. Stubbs SA, Stark J, Dilworth SM, Franks S, Hardy K. J Clin Endocrinol Metab. 2007 Nov;92(11):4418-26. 23-Prolonged survival in culture of preantral follicles from polycystic ovaries. Webber LJ, Stubbs SA, Stark J, Margara RA, Trew GH, Lavery SA, Hardy K, Franks S. J Clin Endocrinol Metab. 2007 May;92(5):1975-8. 24-Formation and early development of follicles in the polycystic ovary. Webber LJ, Stubbs S, Stark J, Trew GH, Margara R, Hardy K, Franks S. Lancet. 2003 Sep 27;362(9389):1017-21. 25-Interpretation of single progesterone measurement in diagnosis of anovulation and defective luteal phase: observations on analysis of the normal range. Wathen NC, Perry L, Lilford RJ, Chard T. Br Med J (Clin Res Ed). 1984 Jan 7;288(6410):7-9. 26-Granulosa cells of polycystic ovaries: are they normal or abnormal? Erickson GF, Magoffin DA, Garzo VG, Cheung AP, Chang RJ. Hum Reprod. 1992 Mar;7(3):293-9. 27-Estradiol production by granulosa cells of normal and polycystic ovaries: relationship to menstrual cycle history and concentrations of gonadotropins and sex steroids in follicular fluid. Mason HD, Willis DS, Beard RW, Winston RM, Margara R, Franks S. J Clin Endocrinol Metab. 1994 Nov;79(5):1355-60. 28-Premature response to luteinizing hormone of granulosa cells from anovulatory women with polycystic ovary syndrome: relevance to mechanism of anovulation. Willis DS, Watson H, Mason HD, Galea R, Brincat M, Franks S. J Clin Endocrinol Metab. 1998 Nov;83(11):3984-91. 29-Etiology of anovulation in polycystic ovary syndrome. Franks S, Mason H, White D, Willis D. Steroids. 1998 May-Jun;63(5-6):306-7. 30-Follicle dynamics and anovulation in polycystic ovary syndrome. Franks S, Stark J, Hardy K. Hum Reprod Update. 2008 Jul-Aug;14(4):367-78. 31-Nutrition, insulin and polycystic ovary syndrome. Franks S, Robinson S, Willis DS. Rev Reprod. 1996 Jan;1(1):47-53. 32-Assessment of anovulation in eumenorrheic women: comparison of ovulation detection algorithms. Lynch KE, Mumford SL, Schliep KC, Whitcomb BW, Zarek SM, Pollack AZ, Bertone-Johnson ER, Danaher M, Wactawski-Wende J, Gaskins AJ, Schisterman EF. Fertil Steril. 2004 Aug;102(2):511-518.e2. 33-Idiopathic hirsutism: an uncommon cause of hirsutism in Alabama. Azziz R, Waggoner WT, Ochoa T, Knochenhauer ES, Boots LR. Fertil Steril. 1998 Aug;70(2):274-8. 34-Prevalence of idiopathic hirsutism. Carmina E. Eur J Endocrinol. 1998 Oct;139(4):421-3. 35-Evolution of the diameters of the largest healthy and atretic follicles during the human menstrual cycle. Gougeon A, Lefèvre B. J Reprod Fertil. 1983 Nov;69(2):497-502. 36-Follicular development during the luteal phase of the human menstrual cycle. McNatty KP, Hillier SG, van den Boogaard AM, Trimbos-Kemper TC, Reichert LE Jr, van Hall EV. J Clin Endocrinol Metab. 1983 May;56(5):1022-31. 37-The dominant ovarian follicle. Hodgen GD. Fertil Steril. 1982 Sep;38(3):281-300. 38-GnRH pulse frequency-dependent differential regulation of LH and FSH gene expression. Thompson IR, Kaiser UB. Mol Cell Endocrinol. 2014 Mar 25;385(1-2):28-35. 39-The frequency of gonadotropin-releasing-hormone stimulation differentially regulates gonadotropin subunit messenger ribonucleic acid expression. Dalkin AC, Haisenleder DJ, Ortolano GA, Ellis TR, Marshall JC. Endocrinology. 1989 Aug;125(2):917-24. 40-Pituitary stalk portal blood collection in rhesus monkeys: evidence for pulsatile release of gonadotropin-releasing hormone (GnRH). Carmel PW, Araki S, Ferin M. Endocrinology. 1976 Jul;99(1):243-8. 41-Frequency and amplitude of gonadotropin-releasing hormone stimulation and gonadotropin secretion in the rhesus monkey. Wildt L, Häusler A, Marshall G, Hutchison JS, Plant TM, Belchetz PE, Knobil E. Endocrinology. 1981 Aug;109(2):376-85. 42-Circulating luteinizing hormone pulse frequency in women with polycystic ovary syndrome. Kazer RR, Kessel B, Yen SS. J Clin Endocrinol Metab. 1987 Aug;65(2):233-6. 43-Opioidergic regulation of LH pulsatility in women with polycystic ovary syndrome. Berga SL, Yen SS. Clin Endocrinol (Oxf). 1989 Feb;30(2):177-84. 44-Inappropriate secretion of follicle-stimulating hormone and luteinizing hormone in polycystic ovarian disease. Yen SS, Vela P, Rankin J. J Clin Endocrinol Metab. 1970 Apr;30(4):435-42. 45-Determinants of abnormal gonadotropin secretion in clinically defined women with polycystic ovary syndrome. Taylor AE, McCourt B, Martin KA, Anderson EJ, Adams JM, Schoenfeld D, Hall JE. J Clin Endocrinol Metab. 1997 Jul;82(7):2248-56. 46-Hyperfunction of the hypothalamic-pituitary axis in women with polycystic ovarian disease: indirect evidence for partial gonadotroph desensitization. Waldstreicher J, Santoro NF, Hall JE, Filicori M, Crowley WF Jr. J Clin Endocrinol Metab. 1988 Jan;66(1):165-72. 47-Genome-wide association of polycystic ovary syndrome implicates alterations in gonadotropin secretion in European ancestry populations. Hayes MG, Urbanek M, Ehrmann DA, Armstrong LL, Lee JY, Sisk R, Karaderi T, Barber TM, McCarthy MI, Franks S,Lindgren CM, Welt CK, Diamanti-Kandarakis E, Panidis D, Goodarzi MO, Azziz R, Zhang Y, James RG, Olivier M,Kissebah AH; Reproductive Medicine Network, Stener-Victorin E, Legro RS, Dunaif A. Nat Commun. 2015 Aug 18;6:7502. 48-Increased protein expression of LHCG receptor and 17α-hydroxylase/17-20-lyase in human polycystic ovaries. Comim FV, Teerds K, Hardy K, Franks S. Hum Reprod. 2013 Nov;28(11):3086-92. 49-Developmental programming: rescuing disruptions in preovulatory follicle growth and steroidogenesis from prenatal testosterone disruption. Veiga-Lopez A, Moeller J, Abbott DH, Padmanabhan V. J Ovarian Res. 2016 Jun 29;9(1):39. 50-Thecal cell sensitivity to luteinizing hormone and insulin in polycystic ovarian syndrome. Cadagan D, Khan R, Amer S. Reprod Biol. 2016 Mar;16(1):53-60. 51-Metabolic regulation of androgen production by human thecal cells in vitro. Nahum R, Thong KJ, Hillier SG. Hum Reprod. 1995 Jan;10(1):75-81. 52-Current concepts of the roles of follicle stimulating hormone and luteinizing hormone in folliculogenesis. Hillier SG. Hum Reprod. 1994 Feb;9(2):188-91. 53-Cellular aspects of pre-ovulatory folliculogenesis in primate ovaries. Hillier SG, Harlow CR, Shaw HJ, Wickings EJ, Dixson AF, Hodges JK. Hum Reprod. 1988 May;3(4):507-11. 54-Intrafollicular paracrine function of ovarian androgen. Hillier SG. J Steroid Biochem. 1987;27(1-3):351-7. 55-The origins and sequelae of abnormal neuroendocrine function in polycystic ovary syndrome. Blank SK, McCartney CR, Marshall JC. Hum Reprod Update. 2006 Jul-Aug;12(4):351-61. 56-Activation of A-type gamma-aminobutyric acid receptors excites gonadotropin-releasing hormone neurons. DeFazio RA, Heger S, Ojeda SR, Moenter SM. Mol Endocrinol. 2002 Dec;16(12):2872-91. 57-Elevated prenatal anti-Müllerian hormone reprograms the fetus and induces polycystic ovary syndrome in adulthood. Tata B, Mimouni NEH, Barbotin AL, Malone SA, Loyens A, Pigny P, Dewailly D, Catteau-Jonard S,Sundström-Poromaa I, Piltonen TT, Dal Bello F, Medana C, Prevot V, Clasadonte J, Giacobini P. Nat Med. 2018 Jun;24(6):834-846. 58-The neuroendocrine genesis of polycystic ovary syndrome: A role for arcuate nucleus GABA neurons. Moore AM, Campbell RE. J Steroid Biochem Mol Biol. 2016 Jun;160:106-17. 59-Depolarising and hyperpolarising actions of GABA(A) receptor activation on gonadotrophin-releasing hormone neurones: towards an emerging consensus. Herbison AE, Moenter SM. J Neuroendocrinol. 2011 Jul;23(7):557-69. 60-Polycystic ovary syndrome: evidence for reduced sensitivity of the gonadotropin-releasing hormone pulse generator to inhibition by estradiol and progesterone. Pastor CL, Griffin-Korf ML, Aloi JA, Evans WS, Marshall JC. J Clin Endocrinol Metab. 1998 Feb;83(2):582-90. 61-Progesterone inhibition of the hypothalamic gonadotropin-releasing hormone pulse generator: evidence for varied effects in hyperandrogenemic adolescent girls. Chhabra S, McCartney CR, Yoo RY, Eagleson CA, Chang RJ, Marshall JC. J Clin Endocrinol Metab. 2005 May;90(5):2810-5. 62-Increased cerebrospinal fluid levels of GABA, testosterone and estradiol in women with polycystic ovary syndrome. Kawwass JF, Sanders KM, Loucks TL, Rohan LC, Berga SL. Hum Reprod. 2017 Jul 1;32(7):1450-1456. 63-Kisspeptins and reproduction: physiological roles and regulatory mechanisms. Pinilla L, Aguilar E, Dieguez C, Millar RP, Tena-Sempere M. Physiol Rev. 2012 Jul;92(3):1235-316. 64-Kisspeptin signaling in the brain. Oakley AE, Clifton DK, Steiner RA. Endocr Rev. 2009 Oct;30(6):713-43. 65-Neuroendocrine control by kisspeptins: role in metabolic regulation of fertility. Navarro VM, Tena-Sempere M. Nat Rev Endocrinol. 2011 Sep 13;8(1):40-53. 66-Minireview: kisspeptin/neurokinin B/dynorphin (KNDy) cells of the arcuate nucleus: a central node in the control of gonadotropin-releasing hormone secretion. Lehman MN, Coolen LM, Goodman RL. Endocrinology. 2010 Aug;151(8):3479-89. 67-Hypertrophy and increased kisspeptin gene expression in the hypothalamic infundibular nucleus of postmenopausal women and ovariectomized monkeys. Rometo AM, Krajewski SJ, Voytko ML, Rance NE. J Clin Endocrinol Metab. 2007 Jul;92(7):2744-50. 68-The kisspeptin system of the human hypothalamus: sexual dimorphism and relationship with gonadotropin-releasing hormone and neurokinin B neurons. Hrabovszky E, Ciofi P, Vida B, Horvath MC, Keller E, Caraty A, Bloom SR, Ghatei MA, Dhillo WS, Liposits Z, Kallo I. Eur J Neurosci. 2010 Jun;31(11):1984-98. 69-Neurokinin B Receptor Antagonism in Women With Polycystic Ovary Syndrome: A Randomized, Placebo-Controlled Trial. George JT, Kakkar R, Marshall J, Scott ML, Finkelman RD, Ho TW, Veldhuis J, Skorupskaite K, Anderson RA, McIntosh S, Webber L. J Clin Endocrinol Metab. 2016 Nov;101(11):4313-4321. 70-Population Pharmacokinetic and Pharmacodynamic Modeling of AZD4901 and Simulation to Support Dose Selection for the Phase 2a Study. Xu H, Li J, Webber L, Kakkar R, Chen Y, Al-Huniti N. J Clin Pharmacol. 2016 Aug;56(8):999-1008. 71-The NK3 Receptor Antagonist ESN364 Interrupts Pulsatile LH Secretion and Moderates Levels of Ovarian Hormones Throughout the Menstrual Cycle. Fraser GL, Hoveyda HR, Clarke IJ, Ramaswamy S, Plant TM, Rose C, Millar RP. Endocrinology. 2015 Nov;156(11):4214-25. 72-Investigating the KNDy Hypothesis in Humans by Coadministration of Kisspeptin, Neurokinin B, and Naltrexone in Men. Narayanaswamy S, Prague JK, Jayasena CN, Papadopoulou DA, Mizamtsidi M, Shah AJ, Bassett P, Comninos AN, Abbara A, Bloom SR, Veldhuis JD, Dhillo WS. J Clin Endocrinol Metab. 2016 Sep;101(9):342. 73-GnRH dysregulation in polycystic ovarian syndrome (PCOS) is a manifestation of an altered neurotransmitter profile. Chaudhari N, Dawalbhakta M, Nampoothiri L. Reprod Biol Endocrinol. 2018 Apr 11;16(1):37. 74-Polycystic ovarian syndrome: evidence that flutamide restores sensitivity of the gonadotropin-releasing hormone pulse generator to inhibition by estradiol and progesterone. Eagleson CA, Gingrich MB, Pastor CL, Arora TK, Burt CM, Evans WS, Marshall JC. J Clin Endocrinol Metab. 2000 Nov;85(11):4047-52. 75-Ontogeny and reversal of brain circuit abnormalities in a preclinical model of PCOS. Silva MS, Prescott M, Campbell RE. JCI Insight. 2018 Apr 5;3(7). 76-Gonadotrophin releasing hormone pulse generator activity before and during sexual maturation in girls: new insights. Yen SS, Apter D, Bützow T, Laughlin GA. Hum Reprod. 1993 Nov;8 Suppl 2:66-71. 77-Serum steroids and pituitary hormones in female puberty: a partly longitudinal study. Apter D. Clin Endocrinol (Oxf). 1980 Feb;12(2):107-20. 78-Pulsatile secretion of luteinizing hormone in children. Jakachi RI, Kelch RP, Sauder SE, Lloyd JS, Hopwood NJ, Marshall JC. J Clin Endocrinol Metab. 1982 Sep;55(3):453-8. 79-The absence of positive feedback between estrogen and luteinizing hormone in sexually immature girls. Reiter EO, Kulin HE, Hammond SM. Pediatr Res. 1974 Aug;8(8):740-5. 80-Adolescent menstrual irregularity. Mansfield MJ, Emans SJ. J Reprod Med. 1984 Jun;29(6):399-410. 81-Menstrual disorders in adolescence. Slap GB. Best Pract Res Clin Obstet Gynaecol. 2003 Feb;17(1):75-92.82-Menstrual irregularities in adolescents: hormonal pattern and ovarian morphology. Venturoli S, Porcu E, Fabbri R, Paradisi R, Ruggeri S, Bolelli G, Orsini LF, Gabbi D, Flamigni C. Horm Res. 1986;24(4):269-79.
83-Incidence of ovulation in the years after the menarche. Metcalf MG, Skidmore DS, Lowry GF, Mackenzie JA. J Endocrinol. 1983 May;97(2):213-9. 84-Follicular growth in relation to serum hormonal patterns in adolescent compared with adult menstrual cycles. Apter D, Räisänen I, Ylöstalo P, Vihko R. Fertil Steril. 1987 Jan;47(1):82-8. 85-Menstruation in girls and adolescents: using the menstrual cycle as a vital sign. American Academy of Pediatrics Committee on Adolescence; American College of Obstetricians and Gynecologists Committee on Adolescent Health Care, Diaz A, Laufer MR, Breech LL. Pediatrics. 2006 Nov;118(5):2245-50. 86-Endocrine and metabolic abnormalities in adolescents with a PCOS-like condition: consequences for adult reproduction. Apter D. Trends Endocrinol Metab. 1998 Feb;9(2):58-61. 87-World Health Organization multicenter study on menstrual and ovulatory patterns in adolescent girls. I. A multicenter cross-sectional study of menarche. World Health Organization Task Force on Adolescent Reproductive Health. J Adolesc Health Care. 1986 Jul;7(4):229-35. 88-The prognosis for adolescents with menstrual abnormalities. Southam AL, Richart RM. Am J Obstet Gynecol. 1966 Mar 1;94(5):637-45. 89-Predictive value of menstrual cycle pattern, body mass index, hormone levels and polycystic ovaries at age 15 years for oligo-amenorrhoea at age 18 years. Van Hooff MH, Voorhorst FJ, Kaptein MB, Hirasing RA, Koppenaal C, Schoemaker J. Hum Reprod. 2004 Feb;19(2):383-92. 90-Prospective follow-up of menstrual disorders in adolescence and prognostic factors. Wiksten-Almströmer M, Hirschberg AL, Hagenfeldt K. Acta Obstet Gynecol Scand. 2008 ;87(11):1162-8. 91-Menstrual disorders and associated factors among adolescent girls visiting a youth clinic. Wiksten-Almströmer M, Hirschberg AL, Hagenfeldt K. Acta Obstet Gynecol Scand. 2007;86(1):65-72. 92-Serum sex hormone levels in adolescent girls with polymenorrhoea. Siegberg R, Nilsson CG, Stenman UH, Widholm O. Ann Clin Res. 1987;19(3):183-6. 93-Endocrine characteristics of adolescent menstrual cycles: impact of early menarche. Vikho R, Apter D. J Steroid Biochem. 1984 Jan;20(1):231-6. 94-Adult polycystic ovary syndrome begins in childhood. Franks S. Best Pract Res Clin Endocrinol Metab. 2002 Jun;16(2):263-72. 95-Adolescent polycystic ovary syndrome due to functional ovarian hyperandrogenism persists into adulthood. Rosenfield RL, Ehrmann DA, Littlejohn EE. J Clin Endocrinol Metab. 2015 Apr;100(4):1537-43. 96-Early puberty-menarche after precocious pubarche: relation to prenatal growth. Ibanez L, Jiménez R, de Zegher F. Pediatrics. 2006 Jan;117(1):117-21. 97-Weight and age at menarche. Stark O, Peckham CS, Moynihan C. Arch Dis Child. 1989 Mar;64(3):383-7. 98-Environmental and genetic factors influence age at menarche in women with polycystic ovary syndrome. Carroll J, Saxena R, Welt CK. J Pediatr Endocrinol Metab. 2013;25(5-6):459-66. 99-Body size from birth to adulthood as a predictor of self-reported polycystic ovary syndrome symptoms. Laitinen J, Taponen S, Martikainen H, Pouta A, Millwood I, Hartikainen AL, Ruokonen A, Sovio U, McCarthy MI, Franks S, Järvelin MR. Int J Obes Relat Metab Disord. 2003 Jun;27(6):710-5.100-Insulin resistance, premature adrenarche, and a risk of the Polycystic Ovary Syndrome (PCOS). Ibáñez L, Potau N, Carrascosa A. Trends Endocrinol Metab. 1998 Feb;9(2):72-7.
101-Premature adrenarche: etiology, clinical findings, and consequences. Voutilainen R, Jääskeläinen J. J Steroid Biochem Mol Biol. 2015 Jan;145:226-36.
102-Hormonal pattern of adolescent menstrual cycles. Apter D, Viinikka L, Vihko R. J Clin Endocrinol Metab. 1978 Nov;47(5):944-54.
103-Polycystic ovary syndrome. Venturoli S, Porcu E, Flamigni C. Curr Opin Pediatr. 1994 Aug;6(4):388-96.
104-Endocrinologic features of oligomenorrheic adolescent girls. Siegberg R, Nilsson CG, Stenman UH, Widholm O. Fertil Steril. 1986 Nov;46(5):852-7.
105-Endocrine determinants of fertility: serum androgen concentrations during follow-up of adolescents into the third decade of life. Apter D, Vihko R . J Clin Endocrinol Metab. 1990 Oct;71(4):970-4.
106-Longitudinal change of sonographic ovarian aspects and endocrine parameters in irregular cycles of adolescence. Venturoli S , Porcu E, Fabbri R, Pluchinotta V, Ruggeri S, Macrelli S, Paradisi R, Flamigni C. Pediatr Res. 1995 Dec;38(6):974-80.
107-Endocrine features of polycystic ovary syndrome in a random population sample of 14-16 year old adolescents. van Hooff MH, Voorhorst FJ, Kaptein MB, Hirasing RA, Koppenaal C, Schoemaker J. Hum Reprod. 1999 Sep;14(9):2223-9.
108-Disruption of the joint synchrony of luteinizing hormone, testosterone, and androstenedione secretion in adolescents with polycystic ovarian syndrome. Veldhius JD, Pincus SM, Garcia-Rudaz MC, Ropelato MG, Escobar ME, Barontini M. J Clin Endocrinol Metab. 2001 Jan;86(1):72-9.
109-Oligomenorrhea in adolescent girls. Emans SJ, Grace E, Goldstein DP.J Pediatr. 1980 Nov;97(5):815-9.
110-Menstrual disorders in college students. Singh KB. Am J Obstet Gynecol. 1981 Jun 1;140(3):299-302.
111-Epidemiology of secondary amenorrhea. I. Incidence and prevalence rates. Pettersson F, Fries H, Nillius SJ. Am J Obstet Gynecol. 1973 Sep 1;117(1):80-6.
112-Prevalence of oligomenorrhea and amenorrhea in a college population. Bachmann GA, Kemmann E. Am J Obstet Gynecol. 1982 Sep 1;144(1):98-102.
113-Secondary amenorrhoea: prevalence and medical contact–a cross-sectional study from a Danish county. Münster K, Helm P, Schmidt L. Br J Obstet Gynaecol. 1992 May;99(5):430-3.
114-Dysfunctional uterine bleeding and other menstrual problems of secondary school students in Adana, Turkey. Demir SC, Kadayıfcı TO, Vardar MA, Atay Y. J Pediatr Adolesc Gynecol.2000Nov;13(4):171-5.
115-Epidemiology of eating disorders: incidence, prevalence and mortality rates. Smink FR, van Hoeken D, Hoek HW. Curr Psychiatry Rep. 2012 Aug;14(4):406-14.
116-Studies of the epidemiology of bulimia nervosa. Fairburn CG, Beglin SJ. Am J Psychiatry. 1990 Apr;147(4):401-8.
117-Anorexia nervosa and a bearded female saint. Lacey JH. Br Med J (Clin Res Ed). 1982 Dec 18-25;285(6357):1816-7.
118-Future recovery of the normal menstrual cycle in adolescent patients with secondary amenorrhea. Morimatsu Y, Matsubara S, Watanabe T, Hashimoto Y, Matsui T, Asada K, Suzuki M. J Obstet Gynaecol Res. 2009Jun;35(3):545-50.
119-Aetiology, previous menstrual function and patterns of neuro-endocrine disturbance as prognostic indicators in hypothalamic amenorrhoea. Perkins RB, Hall JE, Martin KA. Hum Reprod. 2001 Oct;16(10):2198-205.
120-Bulimia nervosa: an ominous variant of anorexia nervosa. Russell G. Psychol Med. 1979 Aug;9(3):429-48.
121-Increased odds of disordered eating in polycystic ovary syndrome: a systematic review and meta-analysis.Lee I, Cooney LG, Saini S, Sammel MD, Allison KC, Dokras A. Eat Weight Disord. 2019 Oct;24(5):787-797.
122-Increased odds of disordered eating in polycystic ovary syndrome: a systematic review and meta-analysis. Lee I, Cooney LG, Saini S, Sammel MD, Allison KC, Dokras A. Eat Weight Disord. 2019 Oct;24(5):787-797.
123-Polycystic ovary syndrome and bulimia. McCluskey S, Evans C, Lacey JH, Pearce JM, Jacobs H. Fertil Steril. 1991 Feb;55(2):287-91.
124-Binge-eating and polycystic ovaries. McCluskey SE, Lacey JH, Pearce JM. Lancet. 1992 Sep 19;340(8821):723.
125-Relative contributions of oligomenorrhea and hyperandrogenemia to the risk of metabolic syndrome in midlife women. Polotsky AJ, Allshouse A, Crawford SL, Harlow SD, Khalil N, Santoro N, Legro RS. J Clin Endocrinol Metab. 2012 Jun;97(6):E868-77. 126-Normo- and hyperandrogenic women with polycystic ovary syndrome exhibit an adverse metabolic profile through life. Pinola P, Puukka K, Piltonen TT, Puurunen J, Vanky E, Sundström-Poromaa I, Stener-Victorin E, Lindén Hirschberg A,Ravn P, Skovsager Andersen M, Glintborg D, Mellembakken JR, Ruokonen A, Tapanainen JS, Morin-Papunen LC. Fertil Steril. 2017 Mar;107(3):788-795. 127-Is the risk for cardiovascular disease increased in all phenotypes of the polycystic ovary syndrome? Daskalopoulos GN, Karkanaki A, Karagiannis A, Mikhailidis DP, Athyros VG. Angiology. 2011 May;62(4):285-90. 128-Long or highly irregular menstrual cycles as a marker for risk of type 2 diabetes mellitus. Solomon CG, Hu FB, Dunaif A, Rich-Edwards J, Willett WC, Hunter DJ, Colditz GA, Speizer FE, Manson JE. JAMA. 2001 Nov 21;286(19):2421-6. 129-Metabolic characteristics of women with polycystic ovaries and oligo-amenorrhoea but normal androgen levels: implications for the management of polycystic ovary syndrome. Barber TM, Wass JA, McCarthy MI, Franks S. Clin Endocrinol (Oxf). 2007 Apr;66(4):513-7. 130-Metabolic cardiovascular disease risk factors in women with self-reported symptoms of oligomenorrhea and/or hirsutism: Northern Finland Birth Cohort 1966 Study. Taponen S, Martikainen H, Järvelin MR, Sovio U, Laitinen J, Pouta A, Hartikainen AL, McCarthy MI, Franks S, Paldanius M,Ruokonen A; Northern Finland Birth Cohort 1966 Study. J Clin Endocrinol Metab. 2004 May;89(5):2114-8. 131-Hyperandrogenemia is implicated in both the metabolic and reproductive morbidities of polycystic ovary syndrome. Sung YA, Oh JY, Chung H, Lee H. Fertil Steril. 2014 Mar;101(3):840-5. 132-Phenotypic variation in hyperandrogenic women influences the findings of abnormal metabolic and cardiovascular risk parameters. Carmina E, Chu MC, Longo RA, Rini GB, Lobo RA.J Clin Endocrinol Metab. 2005 May;90(5):2545-9. 133-Androgen levels in adult females: changes with age, menopause, and oophorectomy. Davison SL, Bell R, Donath S, Montalto JG, Davis SR. J Clin Endocrinol Metab. 2005 Jul;90(7):3847-53.134-Women with polycystic ovary syndrome gain regular menstrual cycles when ageing. Elting MW, Korsen TJ, Rekers-Mombarg LT, Schoemaker J. Hum Reprod. 2000 Jan;15(1):24-8.
135-Serum testosterone levels decrease in middle age in women with the polycystic ovary syndrome. Winters SJ, Talbott E, Guzick DS, Zborowski J, McHugh KP. Fertil Steril. 2000 Apr;73(4):724-9.
136-Age-related differences in features associated with polycystic ovary syndrome in normogonadotrophic oligo-amenorrhoeic infertile women of reproductive years. Bili H, Laven J, Imani B, Eijkemans MJ, Fauser BC. Eur J Endocrinol. 2001 Dec;145(6):749-55.
137-Long-term follow-up of patients with polycystic ovary syndrome: reproductive outcome and ovarian reserve. Hudecova M, Holte J, Olovsson M, Sundström Poromaa I. Hum Reprod. 2009 May;24(5):1176-83.
138-Modulation by insulin of follicle-stimulating hormone and luteinizing hormone actions in human granulosa cells of normal and polycystic ovaries. Willis D, Mason H, Gilling- Smith C, Franks S. J Clin Endocrinol Metab. 1996 Jan;81(1):302-9.
139-Profound peripheral insulin resistance, independent of obesity, in polycystic ovary syndrome. Dunaif A, Segal KR, Futterweit W, Dobrjansky A. Diabetes. 1989 Sep;38(9):1165-74. 140-Prediction models for insulin resistance in the polycystic ovary syndrome. Gennarelli G, Holte J, Berglund L, Berne C, Massobrio M, Lithell H. Hum Reprod. 2000 Oct;15(10):2098-102. 141-Use of fasting blood to assess the prevalence of insulin resistance in women with polycystic ovary syndrome. Carmina E, Lobo RA. Fertil Steril. 2004 Sep;82(3):661-5. 142-Prevalence of insulin resistance in the polycystic ovary syndrome using the homeostasis model assessment. DeUgarte CM, Bartolucci AA, Azziz R. Fertil Steril. 2005 May;83(5):1454-60. 143-The relationship of insulin insensitivity to menstrual pattern in women with hyperandrogenism and polycystic ovaries. Robinson S, Kiddy D, Gelding SV, Willis D, Niththyananthan R, Bush A, Johnston DG, Franks S. Clin Endocrinol (Oxf). 1993 Sep;39(3):351-5. 144-Characterization of groups of hyperandrogenic women with acanthosis nigricans, impaired glucose tolerance, and/or hyperinsulinemia. Dunaif A, Graf M, Mandeli J, Laumas V, Dobrjansky A. J Clin Endocrinol Metab. 1987 Sep;65(3):499-507. 145-Menstrual Cycle Irregularity and Metabolic Disorders: A Population-Based Prospective Study. Rostami Dovom M, Ramezani Tehrani F, Djalalinia S, Cheraghi L, Behboudi Gandavani S, Azizi F. PLoS One. 2016 Dec 16;11(12):e0168402. 146-Long or highly irregular menstrual cycles as a marker for risk of type 2 diabetes mellitus. Solomon CG, Hu FB, Dunaif A, Rich-Edwards J, Willett WC, Hunter DJ, Colditz GA, Speizer FE, Manson JE. JAMA. 2001 Nov 21;286(19):2421-6. 147-Specific insulin binding sites in human ovary. Poretsky L, Smith D, Seibel M, Pazianos A, Moses AC, Flier JS. J Clin Endocrinol Metab. 1984 Oct;59(4):809-11. 148-Distribution and characterization of insulin and insulin-like growth factor I receptors in normal human ovary. Poretsky L, Grigorescu F, Seibel M, Moses AC, Flier JS. J Clin Endocrinol Metab. 1985 Oct;61(4):728-34. 149-Altered expression of insulin and insulin-like growth factor-I receptors in follicular and stromal compartments of polycystic ovaries. Samoto T, Maruo T, Matsuo H, Katayama K, Barnea ER, Mochizuki M. Endocr J. 1993 Aug;40(4):413-24. 150-Insulin receptor expression in follicular and stromal compartments of the human ovary over the course of follicular growth, regression and atresia. Samoto T, Maruo T, Ladines-Llave CA, Matsuo H, Deguchi J, Barnea ER, Mochizuki M. Endocr J. 1993 Dec;40(6):715-26. 151-Insulin action in human granulosa cells from normal and polycystic ovaries is mediated by the insulin receptor and not the type-I insulin-like growth factor receptor. Willis D, Franks S. J Clin Endocrinol Metab. 1995 Dec;80(12):3788-90. 152-Insulin preincubation enhances insulin-like growth factor-II (IGF-II) action on steroidogenesis in human granulosa cells. Mason HD, Willis DS, Holly JM, Franks S. J Clin Endocrinol Metab. 1994 May;78(5):126. 153-Twenty-four-hour mean plasma testosterone concentration declines with age in normal premenopausal women. Zumoff B, Strain GW, Miller LK, Rosner W. J Clin Endocrinol Metab. 1995 Apr;80(4):1429-30. 154-Evidence that granulosa cell aromatase induction/activation by follicle-stimulating hormone is an androgen receptor-regulated process in-vitro. Hillier SG, De Zwart FA. Endocrinology. 1981 Oct;109(4):1303-5. 155-Role of androgens in follicle maturation and atresia. Hillier SG, Tetsuka M. Baillieres Clin Obstet Gynaecol. 1997 Jun;11(2):249-60. 156-Stage-specific expression of androgen receptor, follicle-stimulating hormone receptor, and anti-Müllerian hormone type II receptor in single, isolated, human preantral follicles: relevance to polycystic ovaries. Rice S, Ojha K, Whitehead S, Mason H. J Clin Endocrinol Metab. 2007 Mar;92(3):1034-40. 157-In human granulosa cells from small antral follicles, androgen receptor mRNA and androgen levels in follicular fluid correlate with FSH receptor mRNA. Nielsen ME, Rasmussen IA, Kristensen SG, Christensen ST, Møllgård K, Wreford Andersen E, Byskov AG, Andersen C. Mol Hum Reprod. 2011 Jan;17(1):63-70. 158-Androgens regulate ovarian follicular development by increasing follicle stimulating hormone receptor and microRNA-125b expression. Sen A, Prizant H, Light A, Biswas A, Hayes E, Lee HJ, Barad D, Gleicher N, Hammes SR. Proc Natl Acad Sci U S A. 2014 Feb 25;111(8):3008-13. 159-Cloning of human androgen receptor complementary DNA and localization to the X chromosome. Lubahn DB, Joseph DR, Sullivan PM, Willard HF, French FS, Wilson EM. Science. 1988 Apr 15;240(4850):327-30. 160-Androgen receptor defects: historical, clinical, and molecular perspectives. Quigley CA, De Bellis A, Marschke KB, el-Awady MK, Wilson EM, French FS. Endocr Rev. 1995 Jun;16(3):271-321. 161-The prevalence of polycystic ovaries in patients with congenital adrenal hyperplasia and their close relatives. Hague WM, Adams J, Rodda C, Brook CG, de Bruyn R, Grant DB, Jacobs HS. Clin Endocrinol (Oxf). 1990 Oct;33(4):501-10. 162-Polycystic ovaries in female-to-male transsexuals. Pache TD, Fauser BC. Clin Endocrinol (Oxf). 1993 Dec;39(6):702-3. 163-Immunohistochemical localization of androgen receptor in the human ovary throughout the menstrual cycle in relation to oestrogen and progesterone receptor expression. Horie K, Takakura K, Fujiwara H, Suginami H, Liao S, Mori T. Hum Reprod. 1992 Feb;7(2):184-90. 164-Androgen priming using aromatase inhibitor and hCG during early-follicular-phase GnRH antagonist down-regulation in modified antagonist protocols. Lossl K, Andersen AN, Loft A, Freiesleben NL, Bangsbøll S, Andersen CY. Hum Reprod. 2006 Oct;21(10):2593-600. 165-5alpha-reductase 1 and 2 expression and activity in human ovarian follicles, stroma and corpus luteum as compared to neonatal foreskin. Haning RV, Jr, Tantravahi U, Zhao Q, Hackett RJ, Canick JA. J Steroid Biochem Mol Biol. 1996 Oct;59(2):199-204. 166-5alpha-reductase activity in women with polycystic ovary syndrome. Jakimiuk AJ, Weitsman SR, Magoffin DA. J Clin Endocrinol Metab. 1999 Jul;84(7):2414-8. 167-Sexual hormones in human skin. Zouboulis CC, Chen WC, Thornton MJ, Qin K, Rosenfield R. Horm Metab Res. 2007 Feb;39(2):85-95. 168-Dihydrotestosterone is a peripheral paracrine hormone. Horton R. J Androl. 1992 Jan-Feb;13(1):23-7. 169-Relative binding affinity of anabolic-androgenic steroids: comparison of the binding to the androgen receptors in skeletal muscle and in prostate, as well as to sex hormone-binding globulin. Saartok T, Dahlberg E, Gustafsson JA. Endocrinology. 1984 Jun;114(6):2100-6. 170-How possible is the prevention of polycystic ovary syndrome development in adolescent patients with early onset of hyperandrogenism. Apter D. J Endocrinol Invest. 1998 Oct;21(9):613-7. 171-Risk of venous thromboembolism in women with polycystic ovary syndrome: a population-based matched cohort analysis. Bird ST, Hartzema AG, Brophy JM, Etminan M, Delaney JA. CMAJ. 2013 Feb 5;185(2):E115-20. 172-Combined hormonal contraception and the risk of venous thromboembolism: a guideline. Practice Committee of the American Society for Reproductive Medicine. Fertil Steril. 2017 Jan;107(1):43-51. 173-Different combined oral contraceptives and the risk of venous thrombosis:systematic review and network meta-analysis. Stegeman BH, de Bastos M, Rosendaal FR, van Hylckama Vlieg A, Helmerhorst FM, Stijnen T, Dekkers OM. BMJ. 2013 Sep 12;347:f5298. 174-Pills-related severe adverse events: A case report in Taiwan. Chen CH, Chin HY et al. Taiwan J Obstet Gynecol . 2016 Aug;55(4):588-90. 175-Oral contraceptives and breast cancer risk among younger women. Brinton LA, Daling JR, Liff JM et al. J Nath Cancer Inst. 1995 Jun 7;87(11):827-35. 176-Contemporary Hormonal Contraception and the Risk of Breast Cancer. Mørch LS, Skovlund CW, Hannaford PC, Iversen L, Fielding S, Lidegaard Ø. N Engl J Med. 2017 Dec 7;377(23):2228-2239. 177-Breast cancer and hormonal contraceptives: collaborative reanalysis of individual data on 53 297 women with breast cancer and 100 239 women without breast cancer from 54 epidemiological studies.Collaborative Group on Hormonal Factors in Breast Cancer.Lancet. 1996 Jun 22;347(9017):1713-27. 178-Breast cancer among young U.S. women in relation to oral contraceptive use. White E, Malone KE, Weiss NS, Daling JR. J Natl Cancer Inst. 1994 Apr 6;86(7):505-14. 179-Optimization of Novel Antagonists to the Neurokinin-3 Receptor for the Treatment of Sex-Hormone Disorders (Part II). Hoveyda HR, Fraser GL, Dutheuil G, El Bousmaqui M, Korac J, Lenoir F, Lapin A, Noël S. ACS Med Chem Lett. 2015 May 19;6(7):736-40. 180-Development and validation of the food-craving inventory. White MA, Whisenhunt BL, Williamson DA, Greenway FL, Netemeyer RG. Obes Res. 2002 Feb;10(2):107-14. 181-Binge eating behaviours and food cravings in women with Polycystic Ovary Syndrome. Jeanes YM, Reeves S, Gibson EL, Piggott C, May VA, Hart KH. Appetite. 2017 Feb 1;109:24-32. 182-Clinical review: Insulin sensitizers for the treatment of hirsutism: a systematic review and metaanalyses of randomized controlled trials. Cosma M, Swiglo BA, Flynn DN, Kurtz DM, Labella ML, Mullan RJ, Elamin MB, Erwin PJ, Montori VM. J Clin Endocrinol Metab. 2008 Apr;93(4):1135-42.183- Treatment Options for Hirsutism: A Systematic Review and Network Meta- Analysis . Barrionuevo P, Nabhan M, Altayar O, Wang Z, Erwin PJ, Asi N, Martin KA, Murad MH. J Clin Endocrinol Metab. 2018 Apr 1;103(4):1258-1264.
184-The endocrine effects of spironolactone used as an antiandrogen. Young RL, Goldzieher JW, Elkind-Hirsch K. Fertil Steril. 1987 Aug;48(2):223-8. 185-A systematic review of commonly used medical treatments for hirsutism in women. Koulouri O, Conway GS. Clin Endocrinol (Oxf). 2008 May;68(5):800-5. 186-Comparison of spironolactone, flutamide, and finasteride efficacy in the treatment of hirsutism: a randomized, double blind, placebo-controlled trial. Moghetti P, Tosi F, Tosti A, Negri C, Misciali C, Perrone F, Caputo M, Muggeo M, Castello R. J Clin Endocrinol Metab. 2000 Jan;85(1):89-94. 187-Hormonal effects of flutamide in young women with polycystic ovary syndrome. De Leo V, Lanzetta D, D’Antona D, la Marca A, Morgante G. J Clin Endocrinol Metab. 1998 Jan;83(1):99-102. 188-Ovulatory effects of flutamide in the polycystic ovary syndrome. Paradisi, Fabbri R, Battaglia C, Venturoli S. Gynecol Endocrinol. 2013 Apr;29(4):391-5. 189-Treatment with flutamide, metformin, and their combination added to a hypocaloric diet in overweight-obese women with polycystic ovary syndrome: a randomized, 12-month, placebo-controlled study. Gambineri A, Patton L, Vaccina A, Cacciari M, Morselli-Labate AM, Cavazza C, Pagotto U, Pasquali R. J Clin Endocrinol Metab. 2006 Oct;91(10):3970-80. 190-Effect of finasteride on ovulation induction in nonresponder (hyperandrogenic) polycystic ovary syndrome (PCOS) women. Tartagni M, Cicinelli E, De Pergola G, Lavopa C, Di Naro E, De Salvia MA, Loverro G. Fertil Steril. 2010 Jun;94(1):247-9. 191-Combined Oral Contraception and Bicalutamide in Polycystic Ovary Syndrome and Severe Hirsutism: A Double-Blind Randomized Controlled Trial. Moretti C, Guccione L, Di Giacinto P, Simonelli I, Exacoustos C, Toscano V, Motta C, De Leo V, Petraglia F, Lenzi A.J Clin Endocrinol Metab. 2018 Mar 1;103(3):824-838. 192-An overview of animal toxicology studies with bicalutamide (J Toxicol Sci. 1997 May;22(2):75-88.ICI 176,334). Iswaran TJ, Imai M, Betton GR, Siddall RA. J Toxicol Sci. 1997 May;22(2):75-88. 193-Oral bicalutamide for female pattern hair loss: A pilot study. Fernandez -Nieto D, Saceda-Corralo D, Rodrigues-Barata R, Hermosa-Gelbard A, Moreno-Arrones O, Jimenez-Cauhe J, Ortega-Quijano D, Vano-Galvan S. Dermatol Ther. 2019 Nov;32(6):e13096. 194-Low-dose flutamide-metformin therapy for hyperinsulinemichyperandrogenism in non-obese adolescents and women. Lourdes Ibáñez, and Francis de Zegher. Human Reproduction Update. 2006 Vol.12, No.3 pp. 243–252. 195-Spironolactone and risk of incident breast cancer in women older than 55 years: retrospective, matched cohort study. Mackenzie IS, Macdonald TM, Thompson A, Morant S, Wei L. BMJ. 2012 Jul 13;345:e4447. 196-Spironolactone use and risk of incident cancers: a retrospective, matched cohort study. Mackenzie IS, Morant SV, Wei L, Thompson AM, MacDonald TM. Br J Clin Pharmacol. 2017 Mar;83(3):653-663. 197-Spironolactone use and the risk of breast and gynecologic cancers. Biggar RJ, Andersen EW, Wohlfahrt J, Melbye M. Cancer Epidemiol. 2013 Dec;37(6):870-5 198-Adverse Effects and Safety of 5-alpha Reductase Inhibitors (Finasteride, Dutasteride): A Systematic Review. Hirshburg JM, Kelsey PA, Therrien CA, Gavino AC, Reichenberg JS. J Clin Aesthet Dermatol. 2016 Jul;9(7):56-62.
199-Long term follow-up of patients with polycystic ovarian syndrome after laparoscopic ovarian drilling: clinical outcome. Amer SA, Gopalan V, Li TC, Ledger WL, Cooke ID. Hum Reprod. 2002 Aug;17(8):2035-42.
200-Effects of laparoscopic ovarian drilling on adrenal steroids in polycystic ovary syndrome patients with and without hyperinsulinemia. Saleh A, Morris D, Tan SL, Tulandi T. Fertil Steril. 2001 Mar;75(3):501-4.
201-Success of laparoscopic ovarian wedge resection is related to obesity, lipid profile, and insulin levels. Duleba AJ, Banaszewska B, Spaczynski RZ, Pawelczyk L. Fertil Steril. 2003 Apr;79(4):1008-14.
202-Is Metformin the Answer for Distressed Females with Menstrual Irregularities?Tejpal C, Poudel I, Jahan N. Cureus. 2019 Aug 22;11(8):e5460.
203-Metformin and lifestyle modification in polycystic ovary syndrome: systematic review and meta-analysis.Naderpoor N, Shorakae S, de Courten B, Misso ML, Moran LJ, Teede HJ. Hum Reprod Update. 2015 Sep-Oct;21(5):560-74.
204-Lifestyle changes in women with polycystic ovary syndrome. Moran LJ, Hutchison SK, Norman RJ, Teede HJ. Cochrane Database Syst Rev. 2011 Jul 6;(7):CD0075.
205-Functional integrity of granulosa cells from polycystic ovaries. Almahbobi G, Anderiesz C, Hutchinson P, McFarlane JR, Wood C, Trounson AO. Clin Endocrinol (Oxf). 1996 May;44(5):571-80.
206-Hypersecretion of androstenedione by isolated thecal cells from polycystic ovaries. Gilling-Smith C, Willis DS, Beard RW, Franks S. J Clin Endocrinol Metab. 1994 Oct;79(4):1158-65.
207-Evidence for a primary abnormality of thecal cell steroidogenesis in the polycystic ovary syndrome. Gilling-Smith C, Story H, Rogers V, Franks S. Clin Endocrinol (Oxf). 1997 Jul;47(1):93-9.
Bunları da inceleyin;
Polikistik Over Sendromu’nda Sivilce ve Tedavisi
Polikistik over Sendromu’nda Tüylenme Artışı ve Tedavisi
Doğum Kontrol Hapı Kullanımı ve Polikistik over Sendromu
 Polikistik Over
Polikistik Over