Dr. Burak Hacıhanefioğlu
polikistikover.net internet sitesinde yer alan tıp içerikli yazı ve videoların tümü Kadın Hastalıkları ve Doğum Uzmanı Dr. Burak Hacıhanefioğlu tarafından hazırlanmış olup, telif hakları yasal koruma altına alınmıştır. İzinsiz kaynak gösterilerek dahi başka bir yerde yayınlanamaz.
POLİKSTİK OVER SENDROMU OLAN KADINLAR KISIR MI ?
Polikistik over sendromu olan ve çocuk sahibi olmak isteyen kadınlara çeşitli nedenlerle ”senin çocuğun olmaz, sen kısırsın” veya ”tüp bebek yapılmasından başka çaren yok” denilmesi doğru değildir. Halbuki, tam tersine polikistik over sendromu olan kadınların yumurtalık rezervleri ve üreme kapasiteleri teorik olarak diğer kadınlardan daha fazladır(14,15,16,17,18,19,20,21,22).
Polikistik over sendromu olan kadınların yarısından fazlası gebeliği engelleyen başka bir neden yoksa herhangi bir tedaviye ihtiyaç duymadan gebe kalabilmektedir(100). Hatta, gerek olmadığı halde yapılan tüp bebek tedavisi ile gebe kalamayanların bir kısmı da kendiliğinden bir süre sonra gebe kalmaktadır(202,203,204,205,206,207). Polikistik over sendromu olanların sadece bir kısmı yumurta gelişimi ve yumurtlama olmaması veya gecikmeli olması nedeniyle gebe kalmakta zorluk yaşamaktadır. (14,15,16,17,18,19,20,21,22,23).
Polikistik over sendromu nedeniyle gebe kalmakta zorluk yaşayanlara tüp bebek tedavisi yapılmasına gerek yoktur((101,102,103,104,105,106,107,108,109,110,111,112,113). Günümüzde en çok kullanılan tüp bebek yöntemi olan ICSI (Intra Cytoplasmic Sperm Injection) ile doğal seleksiyon (seçim) gerçekleşmediği için yenidoğan bebekte ve daha sonraki gelişim dönemlerinde otizm (autism) gibi yan etkiler görülebilmektedir. Çeşitli genlerin etkinliğinin (expression) değişmesi (DNA methylation) (epigenetics) sonucunda bu yan etkiler ortaya çıkmaktadır. (118,119,120,121,122,123,124,125,126,127,128,129,130,131,132,133,134,135,136,137,138,139).
Tüp bebek tedavisinin gerçekten uygulanması gereken durumlar olan ileri derecede sperm bozukluğu ve her iki tüpünde (fallop tüpleri) tıkalı olması ya da ileri yaş nedeniyle yumurtalık rezervinin azalması nedenleri dışında polikistik over sendromu olanlarda uygulanması doğru değildir. Halbuki, polikistik over sendromu nedeniyle gebe kalmakta zorluk yaşayan kadınlar çok daha zararsız, kolay uygulanan ve az masraflı yumurta gelişimi ve yumurtlamayı sağlayan (ovulation induction) ilaçlarla birlikte, aşılama (Intrauterine Insemination) yöntemi ile zaten çocuk sahibi olabilmektedir (101,102,103,104,105,106,107,108,109,110,111,112,113).
Polikistik over sendromu nedeniyle çocuk isteği tedavisine yeni başlayan kadınların bir kısmında eşinin sperm sayısında ve hareketinde azlık veya şeklinde bozukluk görülürken, bir kısmının da tüplerinden birinin ya da her ikisinin tıkalı olduğu saptanmaktadır(114,115,116,117). Bu nedenle çocuk isteği tedavisine başlamadan önce polikistik over sendromu ile birlikte, sperm ile ilgili ve sperm ile yumurtanın birleştiği yer olan tüplerin bütünlüğünün bozulmasından kaynaklanan sorunların olup olmadığının belirlenmesi gerekmektedir(114,115). Ancak, polikistik over sendromu’na ek olarak sperm ve tüplerle ilgili sorunların da olması durumunda tüp bebek tedavisi düşünülmelidir.
Polikistik over sendromu olan kadınlarda gebelik oluşumunu zorlaştıran yaşam tarzı alışkanlıklarının çocuk isteği tedavisine başlamadan önce düzenlenmesi gerekmektedir. Sigara, alkol ve kahve tüketimi, beslenme biçimi, kilo fazlalığı veya azlığı, hareket fazlalığı veya azlığı, maruz kalınan zehirli maddeler (toksinler) değiştirilmesi mümkün olan etkenlerdir(140,141,142,143,144).
POLİKİSTİK OVER SENDROMU’NDA SİGARA VE ÇOCUK İSTEĞİ TEDAVİSİ
Sigara alışkanlığı diğer kadınlarda olduğu gibi polikistik over sendromu olan kadınlarda da gebelik oluşumunu zorlaştırmaktadır(145,146,147,148,149,150,151,152,153,159,193,194,195). Sigara dumanında bulunan toksinlerin (cotinine, benzo[a]pyrene, cadmium) yaptığı etki (oxidative stress) DNA hasarına neden olmaktadır(154,155,156,157,158,166,194,195). Bunun sonucunda genetik yapısı bozulan üreme hücreleri (yumurtalar) gebelik oluşturma (fertilization) özelliğini kaybetmektedir (160,185,195). Sigara dumanında bulunan toksinler üreme hücresini (yumurta) içinde taşıyan küçük foliküllerin (antral) (5-10 mm) büyüyerek gebelik oluşturma özelliğine sahip olan yumurtlama öncesi olgun folikül (dominant) (20 mm) halini almasını engellemektedir(8,9,10,11,12,13,164,165,166,171,194). Bu toksinlerin bir kısmı da östrojen (estradiol) ve progesteron hormonlarının üretimini azaltmakla birlikte, erkeklik hormonlarının (androgens) üretimini ve insülin direncini arttırarak olgun folikül oluşumunu ve yumurtlamayı (ovulasyon) engellemektedir (161,162,163,165,171,174,175,176,177,178,179,181,182,183,184,188,191,194,196,199, 200,201). İçilen günlük sigara miktarına paralel olarak gebelik oluşumu gecikmekte, düşük (abortus) yapma ihtimali artmaktadır(145,146,147,148,149,150,151,152,153,159,193,197,199).
Sigara içen kadınlarda yumurtalık rezervinin (primordial follicles) azalması nedeniyle yumurtalık yetmezliği (premature ovarian failure) ihtimali artmaktadır(173,192). Sigara içen kadınların içmeyenlerden daha erken menopoza girdiği görülmektedir(172,180,186,187,189,190,192,198). Erken menopozun görülme zamanı kullanım süresi, içilen toplam sigara miktarı, geçmişte kullanıp bir süre önce bırakmış olunması veya halâ aktif olarak kullanmaya devam edilmesi gibi etkenlere bağlı olarak değişmektedir(172,180,189,190,192,198). Sigaranın kullanım süresi en önemli etken olduğu için sigaranın erken bırakılması erken menopoz ihtimalini azaltmaktadır(192). Gebelik döneminde sigara içilmesi doğacak kız çocuğunun ileride çocuk sahibi olmasını da etkilemektedir. Gebelik döneminde sigara içen kadınlardan doğan kızların (doğum öncesi sigaraya maruz kalan), içmeyen kadınlardan doğanlardan daha zor gebe kaldıkları görülmektedir(167,168,169,170).
POLİKİSTİK OVER SENDROMU’NDA ALKOL VE ÇOCUK İSTEĞİ TEDAVİSİ
Alkol (Etanol) alışkanlığı diğer kadınlarda olduğu gibi polikistik over sendromu olan kadınlarda da gebelik oluşumunu zorlaştırmaktadır(144,208,209,210,211,212,213,214,215). Günde belirli bir miktarın üzerinde alkol kullanan ve çocuk sahibi olmak isteyen kadınlarda, hiç kullanmayanlara ve daha az kullananlara göre canlı bir bebek doğurma ihtimali (fecundity) kullanılan alkol miktarı ile orantılı olarak azalmaktadır(144,208,209,211,212,213,214). Kısa bir sürede fazla miktarda alkol kullanan kadınlarda da, uzun süredir düzenli olarak kullananlarda olduğu gibi yumurtlama (ovulasyon) olmaması (anovulasyon) nedeniyle gebelik oluşumu zorlaşmaktadır(216,217,218,219,220,221,222,223,224,225). Alkol gebelik oluşumunu çeşitli yollarla zorlaştırmaktadır;
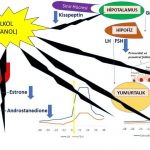
1-Alkol hipotalamusun daha üst seviyelerinde bulunan sinir hücrelerinden salgılanan kisspeptin üretimini azaltarak hipotalamus bölgesinde bulunan sinir hücrelerinden daha az miktarda GnRH (Gonadotropin-releasing hormone) salgılanmasına neden olmaktadır(216,223). GnRH üretiminin azalması yumurtlama öncesi olgun folikül (dominant) gelişimini ve yumurtlamayı (ovulasyon) da engellemektedir(216,223).
2-Alkol Östrojen (estradiol) miktarını arttırmaktadır. Bunu estradiol üretimini arttırarak değil, yıkımını azaltarak yapmaktadır(218,219,220,221,222). Estradiol hormonunun karaciğerde vücuttan atılabilmesi için daha zayıf bir östrojen olan estrone hormonuna dönüşmesi gerekmektedir(229,230). Estradiol hormonunun estrone hormonuna dönüşümünde de alkolün vücuttan atılması için kullanılan enzimler kullanılmaktadır(229,230). Alkollün bu enzimleri kullanması nedeniyle estradiol hormonunun miktarı estrone hormonuna dönüşemediği için artmaktadır(220,221,225,229,230). Estradiol miktarının artması nedeniyle hipofiz bezinde üretilen FSH hormonunun baskılanmasına bağlı olarak doğum kontrol hapı kullanımına ve polikistik over sendromu’na benzer şekilde yumurta gelişimi ve yumurtlama engellenmektedir. (218,219,220,221,222,224,225).
3-Alkol doğrudan yumurtalıklarda granulosa hücrelerinde progesteron üretimini azaltmaktadır. (217,218,219,220). Progesteron hormonunun az miktarda üretilmesi nedeniyle hipofiz de LH üreten hücrelerde bulunan GnRH alıcılarının (receptors) duyarlılığı azaldığı için LH hormonu yeterli miktarda salgılanamamakta ve bunun sonucunda da yumurtlama (ovulasyon) oluşmamaktadır(226,227,228).
4-Kadınlarda alkol kullanımı testosteron miktarını da arttırmaktadır. Bunu da estradiol hormonunda olduğu gibi karaciğerde testosteron yıkımını azaltarak yapmaktadır.
POLİKİSTİK OVER SENDROMU’NDA DOĞUMDAN MENOPOZA KADAR ÜREME HÜCRESİ (YUMURTA) SAYILARI
Adet kanamasının 1. gününden itibaren başlayan ve takip eden adet kanamasının 1. gününe kadar devam eden dönem bir adet döngüsünü oluşturur (Örneğin; 30 gün). Bir adet döngüsünün sonunda adet kanamasının olması o adet döngüsü içinde yumurtanın (üreme hücresi) büyüdüğünü ve yumurtlamanın (ovulasyon) olduğunu göstermektedir.
∗Polikistik over sendromu olan kadınların bir kısmı yumurta gelişimi ve yumurtlama olmaması veya gecikmeli olması nedeniyle gebe kalmakta zorluk yaşamaktadır. Bu nedenle örneğin; Adet kanamaları 21 ila 35 gün arasında değişen aralıklarla düzenli olan bir kadın 3 ay içinde gebe kalabilirken, polikistik over sendromu olduğu için adet kanaması 2 ay aralıklarla olan bir kadın ancak 6 ay içinde gebe kalabilmektedir.
∗Polikistik over sendromu olan kadınların bir kısmında ise 21 ila 35 gün arasında değişen aralıklarla düzenli adet kanaması olmasına rağmen yumurta gelişimi ve yumurtlama olmamaktadır. Bu kadınlar da sanki doğum kontrol hapı kullanıyormuş gibi gebe kalmakta zorluk yaşamaktadır.
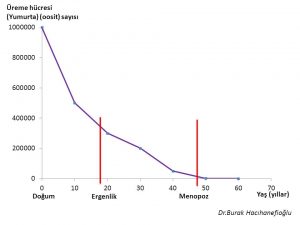
Gebeliğin 20. haftasında fetus yumurtalıklarında yaklaşık 7 milyon üreme hücresi (oocyte) vardır(1,2,3,5). Hızlı bir şekilde öldükleri (atresia) (apoptosis) için doğumda yaklaşık 1 milyon üreme hücresi kalmaktadır(1,2,3,4,5). Ergenlik döneminin başında üreme hücresi sayısı 400 bin civarına inmektedir. Ergenlik döneminden itibaren menopoz dönemine kadar her adet döngüsünde (menstrual cycle) yumurtlama (ovulation) için bir yumurta kullanılmaktadır(1,2,6). Ergenlik döneminden itibaren menopoz dönemine kadar yumurtlamanın olduğu adet döngülerinin (menstrual cycle) toplamında yaklaşık 400 tane yumurta kullanılmaktadır(1,2,5,6,7). Bir yumurtlamanın olduğu her adet döngüsünde 1000 tane yumurta da ölmektedir (atresia) (apoptosis)(1,2,5,6,7). Bunun sonucunda menopoz öncesi dönemde yumurta sayısı 1000 civarına kadar inmekte ve bir süre sonra menopoz döneminde de bitmektedir(1,2,5,6).
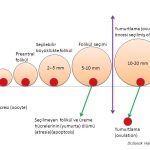
Bir adet döngüsünde (menstrual cycle) üreme hücresini (oosit) içinde taşıyan küçük foliküllerden (antral) (5-10 mm) bir tanesi seçildikten sonra yumurtlama öncesi olgun folikül (dominant) (20 mm) halini almaktadır(8,9,10,11,12,13). Yumurtlama (ovulasyon) bu folikül içinden üreme hücresinin (oosit) dışarıya çıkmasıyla oluşmaktadır(8,9,10,11).
POLİKİSTİK OVER SENDROMU’NDA YUMURTA GELİŞİMİ VE YUMURTLAMA
1-Polikistik over sendromu olan kadınlarda üreme hücrelerini (oocyte) içinde taşıyan dinlenme aşamasında bulunan en küçük foliküllerde (resting follicles) (primordial folikül) hızlı bir büyüme görülmektedir(14,15). Hızlı büyüyen bu küçük foliküllerin ölüm (atresia) (apoptosis) oranları da düşük olup canlılıklarını (survival) sürdürmektedirler(16,18,19). Bunun sonucunda folikül seçimi (5-10 mm) öncesinde bulunan ve daha küçük (< 2 mm) (preantal) foliküllerin sayısı artmaktadır(14,15,16,17).
2-Polikistik over sendromu olan kadınlarda folikül seçimi aşamasına (5-10 mm) gelmiş foliküllerden bir tanesi seçilerek daha ileri aşamaya geçememektedir (arrested follicles). Bunun sonucunda yumurtlama (ovulation) öncesi (preovulatory) olgunluğa ulaşmış bir folikül (dominant) oluşmamaktadır(20,21,22,23).
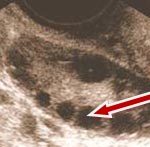
Yumurtalığın ortasında bulunan beyaz alanın çevresine dizilmiş kırmızı renkli ok ile işaret edilen siyah renkli, küçük keseciklerin (preantral ve antral folikül) içinde yumurtalar bulunmaktadır.
Polikistik over sendromu olan veya olmayan kadınlarda yumurtlama (ovulation) meydana geldikten yaklaşık 14 gün sonra adet kanaması (menstruation) başlamaktadır. Polikistik over sendromu’nda adet döngüsünde ( menstrual cycle) görülen düzensizliğin nedeni, seçilmiş bir folikülün gelişip yumurtlama (ovulation) öncesi olgun folikül (preovulatory) (dominant) aşamasına ulaşmasının uzun zaman alması (oligo-ovulation) ya da ulaşamamasıdır (anovulation) (20,21,22,23).
Adet kanamaları 21 ila 35 gün arasında değişen aralıklarla (eumenorrhea) düzenli olan kadınlarda yumurtlama (ovulation) öncesi (preovulatory) olgunluğa ulaşmış bir folikülün (dominant) oluştuğu ve bunu takiben yumurtlamanın (ovulation) meydana geldiği kabul edilmektedir (8,12,13,24). Fakat, kadınların küçük bir kısmında ise 21 ila 35 gün arasında (eumenorrhea) düzenli adet kanamaları olmasına rağmen yumurtlama (ovulation) öncesi olgun folikül (preovulatory) (dominant) ve takiben yumurtalama (ovulation) olmamaktadır (25). 21 ila 35 gün arasında (eumenorrhea) düzenli adet kanamaları olmasına rağmen yumurtlama (ovulation) olmayanların oranı polikistik over sendromu olan kadınlarda çok daha fazladır (26).
Erkeklik hormonlarının (testosteron, dihidrotestosteron) miktarındaki artışa (hyperandrogenism) bağlı tüylenme artışı, sivilce ve saç dökülmesi görülen kadınların bir kısmında 21 ila 35 günde bir (eumenorrhea) düzenli adet kanamaları olmasına rağmen bunların yaklaşık yarısı olgun folikül (preovulatory) (dominant) gelişmediği için yumurtlama (ovulation) olmadan meydana gelmektedir (26,27,28).
POLİKİSTİK OVER SENDROMU’NDA İNSÜLİN DİRENCİ VE ÇOCUK İSTEĞİ TEDAVİSİ
Polikistik over sendromu’nda fazla kilolu ve şişman olan veya normal kilolu fakat bel çevresi kalın (erkek tipi yağlanma) olan kadınların büyük çoğunluğunda insülin direnci görülmektedir(29,30,31,32). İnsülin direnci nedeniyle kan dolaşımında fazla miktarda bulunan insülin hormonu polikistik over sendromu olan kadınların bir kısmında hem doğrudan yumurtalığa giderek hem de hipofiz bezinde LH (luteinizing hormon) üretimini arttırarak olgun folikül (preovulatory) (dominant) oluşumunu ve takiben yumurtlamayı (ovulation) engellemektedir(22,33). Bunun sonucunda adet kanamaları 35 gün ile 3 ay arasında değişen aralıklarla (oligomenorrhea) veya 3 aydan daha uzun aralıklarla (amenorrhea) olanlarda adet kanamaları 21 ila 35 günde bir (eumenorrhea) olanlara göre insülin direnci ve şeker hastalığı (diabetes mellitus ) daha sık görülmektedir(34,35,36,37,38). Adet kanamalarının görülme aralıkları uzadıkça insülin direncinin şiddeti de artmaktadır(34,37,38).
Üreme hücrelerini (oocyte) içinde taşıyan foliküllerde (granulosa ve theca hücreleri) insülin hormonu alıcıları (receptors) bulunmaktadır(39,40,41,42,43,44).
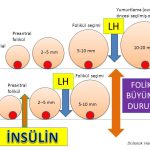
Polikistik over sendromu olan kadınların bir kısmında insülin direncine bağlı fazla miktarda üretilen insülin (hiperinsülinemi) hormonu ile fazla miktarda üretilen LH (luteinizing hormon) alıcılara (receptors) tutunarak folikül seçimi aşamasına (5- 10 mm) gelmiş foliküllerin yumurtlama (ovulation) öncesi (preovulatory) olgun folikül (dominant) aşamasına ulaşmadan erken dönemde büyümesinin durmasına (premature arrest) neden olmaktadır(20,21,41,42,43,44,45). Bu nedenle folikül seçimi aşamasına (5-10 mm) gelmiş foliküllerden bir tanesi seçilerek daha ileri aşamaya geçememektedir (arrested follicles). Bunun sonucunda da yumurtlama olmamaktadır (anovulasyon)(20,21,43).
POLİKİSTİK OVER SENDROMU’NDA ERKEKLİK HORMONLARI (TESTOSTERON) VE ÇOCUK İSTEĞİ TEDAVİSİ
Erkeklik hormonları (androgens) yumurtalıklarda en küçük foliküllerin (primordial) büyümesiyle (initiation) oluşan küçük foliküllerden (preantral) itibaren yumurtlama öncesi olgun folikül (preovulatory) aşamasına kadar hatta yumurtlama sonrasında bile folikülü oluşturan hücrelerde (granulosa, theca, oocyte) bulunan alıcılara (receptors) tutunarak etkili olmaktadır(46,47,48,49,50).
Üreme hücrelerini (oocyte) içinde taşıyan dinlenme aşamasında bulunan en küçük foliküllerin (resting follicles) (primordial folikül) büyümeye başlaması ve bu foliküllerin ölmeden (atresia) (apoptosis) canlılıklarını (survival) sürdürebilmesi için belirli miktarlarda erkeklik hormonlarına (androgens) ihtiyaçları vardır(51,52,53).
Kadınlarda 30′ lu ve 40′ lı yaşlardan sonra erkeklik hormonlarının miktarları azalmaktadır(54,55). Menopoz öncesi dönemde yumurta sayısının azalması ile birlikte erkeklik hormonları (testosteron, dihidrotestosteron) da azaldığı için kendiliğinden (spontaneous) gebe kalınması zorlaşmaktadır(56). Hatta 30′ lu ve 40′ lı yaşlardan sonra erkeklik hormonlarının azalması çocuk isteği tedavisi nedeniyle yumurta (oocyte) taşıyan folikülleri büyütmek için kullanılan ilaçların etkisini azaltmaktadır(56,57).
5- α reduktaz (reductase) enzimi yumurtalıklarda yumurtaları (oocytes) içinde taşıyan folikülleri oluşturan hücrelerde (granulosa, theca) bulunmaktadır(58,59). 5- α reduktaz (reductase) enzimi testosteron hormonunu 10 kat daha güçlü bir etkiye sahip olan dihidrotestosteron (dhydrotestosterone) hormonuna dönüştürmektedir(60,61,64). Polikistik over sendromu olan kadınların yumurtalıklarında 5- α reduktaz (reductase) enziminin etkinliği (activity) polikistik over sendromu olmayanlardan çok daha fazla olup daha fazla miktarda dihidrotestosteron üretmektedir(59).
Böbrek üstü bezinde fazla miktarda erkeklik hormonu üretilen kadınlarda (congenital adrenal hyperplasia) ve kadından erkeğe cinsiyet değişikliği (female-to-male transsexulas) amacıyla erkeklik hormonu kullananlarda polikistik over sendromu’nda olduğu gibi üreme hücrelerini (oocyte) içinde taşıyan dinlenme aşamasında bulunan en küçük foliküllerde (resting follicles) (primordial folikül) hızlı bir büyüme görülmektedir(62,63). Bunun sonucunda folikül seçimi (5-10 mm) öncesinde bulunan ve daha küçük (< 2 mm) (preantal) foliküllerin sayısı artmaktadır. Fakat, folikül seçimi aşamasına (5-10 mm) gelmiş foliküllerden bir tanesi seçilerek daha ileri aşamaya geçememektedir (arrested follicles)(62,63).
Kadınlarda erkeklik hormonlarının (androgens) fazlalığı (hyperandrogenism) da azlığı (hypoandrogenism) da yumurta gelişimini (folliculogenesis) ve yumurtlamayı (ovulation) engellediği için adet düzensizliği ile birlikte gebe kalmayı da zorlaştırmaktadır.
POLİKİSTİK OVER SENDROMU’NDA BEYİN (HİPOTALAMUS, HİPOFİZ) VE ÇOCUK İSTEĞİ TEDAVİSİ
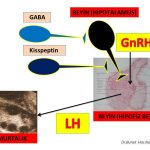
Beyinde hipotalamus bölgesinde GnRH (Gonadotropin-releasing hormone) salgılayan sinir hücreleri (neurons) bulunmaktadır(65,66). GnRH hormonunun belirli aralıklarla artışlar ve azalışlar gösterek (pulsatile) salgılanmasına bağlı olarak hipofiz bezinde LH ve FSH hormonların üretim sıklığı (frequency) ve miktarları (amplitude) belirlenmektedir(67,68,69). Polikistik over sendromu olan kadınların bir kısmında GnRH hormonu salgılayan jeneratörün (dinamo) beyinde fazla çalışmasına (hyperactive) bağlı olarak GnRH hormonunun belirli aralıklarla (pulsatile) salgılanma sıklığında artış görülmektedir. Bunun sonucunda polikistik over sendromu olan kadınların bir kısmında hipofiz bezinde LH hormonunun üretim sıklığı (frequency), miktarı (amplitude) ve kan dolaşımında bulunan (basal) miktarı artmaktadır(67,69,70,71,72,73,74,75,82) Erkeklik hormonlarının yumurtalıkta yapılmasını sağlayan LH (luteinizing hormon) miktarının artması erkeklik hormonlarının yapımını arttırmakla (hiperandrogenism) birlikte yumurtlama öncesi olgun folikül (dominant) gelişimini ve yumurtlamayı (ovulasyon) da engellemektedir(19,20,21,22,69,75,76,77,78,79,80,81).
Polikistik over sendromu olan kadınların bir kısmında GnRH hormonu salgılayan jeneratörün (dinamo) fazla çalışmasına (hyperactive) neden olan beyinde daha üst seviyelerde bulunan sinir hücreleri (neurons) vardır(56,58,59,63,64,65,66). Bu sinir hücrelerinden GABA ve Kisspeptin (neurotransmitters) salgılanmaktadır. Kisspeptin salgılayan sinir hücrelerinin bir kısmından Neurokinin B (NKB) ve Dynorphin (neurotransmitters) de salgılanmaktadır(66,67,69,70,71,72,73). Bu maddeler (neurotransmitters) polikistik over sendromu olan kadınlarda hipofiz bezinde üretilen LH hormonu miktarı ile birlikte salgılanma zamanının sıklığını (frequency) da arttırmaktadır(83,84,85,86,87,88,89,90,91,92,93,94,95,96,97).
Polikistik over sendromu olan kadınların bir kısmında erkeklik hormonlarının (testosteron, dihidrotestosteron) fazla miktarda üretilmesi (hyperandrogenism) ve insülin direncine bağlı insülin miktarının artması (hyperinsulinemia) beyinde GnRH hormonu salgılayan jeneratörün (dinamo) fazla çalışmasına (hyperactive) neden olmaktadır(85,90,98,99). Erkeklik hormonları (testosteron, dihidrotestosteron) ve insülin bunu GnRH (Gonadotropin-releasing hormone) salgılayan sinir hücrelerinden (neurons) daha üst seviyelerdeki sinir hücrelerinde üretilen GABA ve Kisspeptin (neurotransmitters) salgılanmasını etkileyerek yapmaktadır(67,90,98,99).
POLİKİSTİK OVER SENDROMU’NDA ÇOCUK İSTEĞİ TEDAVİSİ
TEDAVİNİN AMAÇLARI;
1-Yumurtalıklarda erkeklik hormonu (androgen) üretimini arttıran beyinde bulunan GnRH hormonu salgılayan jeneratörün (dinamo) artmış olan etkinliğinin (activity) azaltılması,
2-Erkeklik hormonlarının yumurtalıklarda (ovaries) artmış olan üretiminin ve etkinliğinin azaltılması,
3-İnsülin direncine bağlı fazla miktarda üretilen insülin (hiperinsülinemi) hormonu miktarının azaltılması
TEDAVİNİN SONUÇLARI;
1-İleri aşamaya geçememiş (arrested follicles) olan yumurtayı içinde taşıyan küçük keseciğin (folikül) büyümesi (folliculogenesis)
2-Yumurtlama (ovulation)
Bu kadınlarda gebelik oluşması için ultrason yardımıyla yumurtayı taşıyan küçük keseciğin büyümesi doğal yolla veya keseciğin büyümesi için yardımcı ilaçlar kullanılarak takip edilmektedir. Yumurtlamanın olup olmadığı ultrason ve kan tahlili (progesteron hormonu) ile tespit edilmektedir. Belirli bir büyüklüğe gelen keseciğin duvarı LH hormonu miktarının kanda en üst düzeye ulaşmasından yaklaşık 36 saat sonra çatlar ve yumurta dışarıya atılır ve yumurtlama (ovulasyon) gerçekleşir.
Yumurtlamanın olduğu tespit edildikten sonraki bu dönemde ilişkide bulunulması önerilmektedir. Sperm sayısının azlığı, hareket ve şekil bozukluğu gibi erkekten kaynaklanan başka sorunlar da varsa aşılama (İntrauterin inseminasyon) tercih edilmektedir. Buraya kadar anlatılan yöntemler yardımıyla polikistik over sendromu olan kadınların büyük çoğunluğu gebe kalabilmektedir.
Polikistik over sendromu’nda çocuk isteği tedavisinde laparoskopik ovarian drilling ameliyatı özellikle hastaların bir kısmında faydalı olmaktadır. Önemli olan ameliyattan fayda görecek olan hastanın doğru seçilmesidir. Bu ameliyat çocuk isteği tedavisinde yumurtayı içinde taşıyan küçük keseciğin büyümesini ve yumurtlamayı sağlar. Polikistik over ameliyatı miktarı ve etkinliği artmış olan erkeklik hormonlarının (testosteron, androstenedion, dihidrotestosteron) etkinliğini ve miktarını azaltarak ve insülin direncine karşı insülin duyarlılığını artırarak etki gösteren bir tedavi seçeneğidir.
Kadının polikistik over sendromu’nun hangi grubuna (A,B,C) girdiği, ultrasonda yumurtalıklarının görünümü, erkeklik hormonlarının (testosteron ve androstenedion) ve erkeklik hormonlarının aktif formu olan Dihidrotestosteron ve onun yıkım ürünü (metabolit) olan 3 α- androstanediol glucuronide kan düzeyleri, erkeklik hormonlarına bağlanarak onları etkisiz hale getiren Sex Hormone Binding Globulin miktarı ve yumurta gelişimi ve yumurtama ile ilişkili olan Anti- Müllerian Hormon (AMH) miktarı, insülin direnci, şeker hastalığı, kilo fazlalığı ve şişmanlık olup olmaması ameliyat tedavisinden fayda görecek olan kadının belirlenmesinde önem taşımaktadır.
Tüp bebek tedavisi (IVF) sperm sayısının çok az miktarda olduğu veya spermlerde ileri derecede hareket ve şekil bozukluğunun olduğu erkekten kaynaklanan sorunlarda veya sperm ve yumurtanın birleştiği yer olan tüplerin (fallop tüpleri) bütünlüğünün ve iletiminin bozulduğu tüplerden kaynaklanan sorunlarda uygulanmaktadır.
Polikistik over sendromu olan kadınların büyük bir kısmı tüp bebek tedavisine gerek kalmadan daha basit tedavi yöntemleriyle hamile kalabilmektedir. Bu nedenle polikistik over sendromu’nda tüp bebek tedavisinin öncelikli bir yeri yoktur. Ancak yumurta gelişimi ve yumurtlama sorunu ile birlikte erkekten veya kadının tüplerinden kaynaklanan başka sorunlarda varsa tüp bebek tedavisi tercih edilebilir.
Tedavi seçenekleri kadının yaşı, polikistik over sendromu’nun tipi (A,B,C), ultrasonda yumurtalıkların görünümü, kilo fazlalığı, şişmanlık, insülin direnci ve şeker sorunları, yumurta gelişimi ve yumurtlama sorunu ile birlikte erkekten veya kadının tüplerinden kaynaklanan başka sorunların olup olmamasına göre kişiden kişiye farklı şekillerde bazen birden fazla tedavi seçeneği birlikte, bazen de bir tedavi seçeneği tek başına uygulanmaktadır.
Kaynaklar
1-Oocyte apoptosis: like sand through an hourglass. Morita Y, Tilly JL. Dev Biol. 1999 Sep 1;213(1):1-17. 2-Ovarian follicle atresia: a hormonally controlled apoptotic process. Hsueh AJ, Billig H, Tsafriri A. Endocr Rev. 1994 Dec;15(6):707-24. 3-Morphometric study of the human neonatal ovary. Forabosco A, Sforza C, De Pol A, Vizzotto L, Marzona L, Ferrario VF. Anat Rec. 1991 Oct;231(2):201-8. 4-Follicular atresia in the infant human ovary. Himelstein-Braw R, Byskov AG, Peters H, Faber M. J Reprod Fertil. 1976 Jan;46(1):55-9. 5-Accelerated disappearance of ovarian follicles in mid-life: implications for forecasting menopause. Faddy MJ, Gosden RG, Gougeon A, Richardson SJ, Nelson JF. Hum Reprod. 1992 Nov;7(10):1342-6. 6-Age-related changes of the population of human ovarian follicles: increase in the disappearance rate of non-growing and early-growing follicles in aging women. Gougeon A, Ecochard R, Thalabard JC. Biol Reprod. 1994 Mar;50(3):653-63. 7-Biological and clinical importance of ovarian cell death. Tilly JL, Ratts VS. Contemp Ob Gyn. 1996 March:59-86. 8-Regulation of ovarian follicular development in primates: facts and hypotheses. Gougeon A . Endocr Rev. 1996 Apr;17(2):121-55. 9-The microenvironment of the human antral follicle: interrelationships among the steroid levels in antral fluid, the population of granulosa cells, and the status of the oocyte in vivo and in vitro. Mc Natty KP, Smith DM, Makris A, Osathanondh R, Ryan KJ. J Clin Endocrinol Metab. 1979 Dec;49(6):851-60. 10-Morphological and endocrinological studies on follicular development during the human menstrual cycle. Chikazawa K, Araki S, Tamada T. J Clin Endocrinol Metab. 1986 Feb; 62(2):305-13. 11-Aspects of ovarian follicle development throughout life. Macklon NS, Fauser BC. Horm Res. 1999;52(4):161-70. 12-Evolution of the diameters of the largest healthy and atretic follicles during the human menstrual cycle. Gougeon A, Lefèvre B. J Reprod Fertil. 1983 Nov;69(2):497-502. 13-The dominant ovarian follicle. Hodgen GD. Fertil Steril. 1982 Sep;38(3):281-300. 14-Morphology and morphogenesis of the Stein-Leventhal ovary and of so-called “hyperthecosis”. Hughesdon PE. Obstet Gynecol Surv. 1982 Feb;37(2):59-77. 15-Abnormal preantral folliculogenesis in polycystic ovaries is associated with increased granulosa cell division. Stubbs SA, Stark J, Dilworth SM, Franks S, Hardy K. J Clin Endocrinol Metab. 2007 Nov;92(11):4418-26. 16-Prolonged survival in culture of preantral follicles from polycystic ovaries. Webber LJ, Stubbs SA, Stark J, Margara RA, Trew GH, Lavery SA, Hardy K, Franks S. J Clin Endocrinol Metab. 2007 May;92(5):1975-8. 17-Formation and early development of follicles in the polycystic ovary. Webber LJ, Stubbs S, Stark J, Trew GH, Margara R, Hardy K, Franks S. Lancet. 2003 Sep 27;362(9389):1017-21. 18-Granulosa cells of polycystic ovaries: are they normal or abnormal? Erickson GF, Magoffin DA, Garzo VG, Cheung AP, Chang RJ. Hum Reprod. 1992 Mar;7(3):293-9. 19-Estradiol production by granulosa cells of normal and polycystic ovaries: relationship to menstrual cycle history and concentrations of gonadotropins and sex steroids in follicular fluid. Mason HD, Willis DS, Beard RW, Winston RM, Margara R, Franks S. J Clin Endocrinol Metab. 1994 Nov;79(5):1355-60. 20-Premature response to luteinizing hormone of granulosa cells from anovulatory women with polycystic ovary syndrome: relevance to mechanism of anovulation. Willis DS, Watson H, Mason HD, Galea R, Brincat M, Franks S. J Clin Endocrinol Metab. 1998 Nov;83(11):3984-91. 21-Etiology of anovulation in polycystic ovary syndrome. Franks S, Mason H, White D, Willis D. Steroids. 1998 May-Jun;63(5-6):306-7. 22-Follicle dynamics and anovulation in polycystic ovary syndrome. Franks S, Stark J, Hardy K. Hum Reprod Update. 2008 Jul-Aug;14(4):367-78. 23-Nutrition, insulin and polycystic ovary syndrome. Franks S, Robinson S, Willis DS. Rev Reprod. 1996 Jan;1(1):47-53. 24-Follicular development during the luteal phase of the human menstrual cycle. McNatty KP, Hillier SG, van den Boogaard AM, Trimbos-Kemper TC, Reichert LE Jr, van Hall EV. J Clin Endocrinol Metab. 1983 May;56(5):1022-31. 25-Assessment of anovulation in eumenorrheic women: comparison of ovulation detection algorithms. Lynch KE, Mumford SL, Schliep KC, Whitcomb BW, Zarek SM, Pollack AZ, Bertone-Johnson ER, Danaher M, Wactawski-Wende J, Gaskins AJ, Schisterman EF. Fertil Steril. 2004 Aug;102(2):511-518.e2. 26-The severity of menstrual dysfunction as a predictor of insulin resistance in PCOS. Brower M, Brennan K, Pall M, Azziz R. J Clin Endocrinol Metab. 2013 Dec;98(12):E1967-71. 27-Idiopathic hirsutism: an uncommon cause of hirsutism in Alabama. Azziz R, Waggoner WT, Ochoa T, Knochenhauer ES, Boots LR. Fertil Steril. 1998 Aug;70(2):274-8. 28-Prevalence of idiopathic hirsutism. Carmina E. Eur J Endocrinol. 1998 Oct;139(4):421-3. 29-Profound peripheral insulin resistance, independent of obesity, in polycystic ovary syndrome. Dunaif A, Segal KR, Futterweit W, Dobrjansky A. Diabetes. 1989 Sep;38(9):1165-74. 30-Prediction models for insulin resistance in the polycystic ovary syndrome. Gennarelli G, Holte J, Berglund L, Berne C, Massobrio M, Lithell H. Hum Reprod. 2000 Oct;15(10):2098-102. 31-Use of fasting blood to assess the prevalence of insulin resistance in women with polycystic ovary syndrome. Carmina E, Lobo RA. Fertil Steril. 2004 Sep;82(3):661-5. 32-Prevalence of insulin resistance in the polycystic ovary syndrome using the homeostasis model assessment. DeUgarte CM, Bartolucci AA, Azziz R. Fertil Steril. 2005 May;83(5):1454-60. 33-Long-term follow-up of patients with polycystic ovary syndrome: reproductive outcome and ovarian reserve. Hudecova M, Holte J, Olovsson M, Sundström Poromaa I. Hum Reprod. 2009 May;24(5):1176-83. 34-The severity of menstrual dysfunction as a predictor of insulin resistance in PCOS. Brower M, Brennan K, Pall M, Azziz R. J Clin Endocrinol Metab. 2013 Dec;98(12):E1967-71. 35-The relationship of insulin insensitivity to menstrual pattern in women with hyperandrogenism and polycystic ovaries. Robinson S, Kiddy D, Gelding SV, Willis D, Niththyananthan R, Bush A, Johnston DG, Franks S. Clin Endocrinol (Oxf). 1993 Sep;39(3):351-5. 36-Characterization of groups of hyperandrogenic women with acanthosis nigricans, impaired glucose tolerance, and/or hyperinsulinemia. Dunaif A, Graf M, Mandeli J, Laumas V, Dobrjansky A. J Clin Endocrinol Metab. 1987 Sep;65(3):499-507. 37-Menstrual Cycle Irregularity and Metabolic Disorders: A Population-Based Prospective Study. Rostami Dovom M, Ramezani Tehrani F, Djalalinia S, Cheraghi L, Behboudi Gandavani S, Azizi F. PLoS One. 2016 Dec 16;11(12):e0168402. 38-Long or highly irregular menstrual cycles as a marker for risk of type 2 diabetes mellitus. Solomon CG, Hu FB, Dunaif A, Rich-Edwards J, Willett WC, Hunter DJ, Colditz GA, Speizer FE, Manson JE. JAMA. 2001 Nov 21;286(19):2421-6. 39-Specific insulin binding sites in human ovary. Poretsky L, Smith D, Seibel M, Pazianos A, Moses AC, Flier JS. J Clin Endocrinol Metab. 1984 Oct;59(4):809-11. 40-Distribution and characterization of insulin and insulin-like growth factor I receptors in normal human ovary. Poretsky L, Grigorescu F, Seibel M, Moses AC, Flier JS. J Clin Endocrinol Metab. 1985 Oct;61(4):728-34. 41-Altered expression of insulin and insulin-like growth factor-I receptors in follicular and stromal compartments of polycystic ovaries. Samoto T, Maruo T, Matsuo H, Katayama K, Barnea ER, Mochizuki M. Endocr J. 1993 Aug;40(4):413-24. 42-Insulin receptor expression in follicular and stromal compartments of the human ovary over the course of follicular growth, regression and atresia. Samoto T, Maruo T, Ladines-Llave CA, Matsuo H, Deguchi J, Barnea ER, Mochizuki M. Endocr J. 1993 Dec;40(6):715-26.43-Insulin action in human granulosa cells from normal and polycystic ovaries is mediated by the insulin receptor and not the type-I insulin-like growth factor receptor. Willis D, Franks S. J Clin Endocrinol Metab. 1995 Dec;80(12):3788-90.
44-Insulin preincubation enhances insulin-like growth factor-II (IGF-II) action on steroidogenesis in human granulosa cells. Mason HD, Willis DS, Holly JM, Franks S. J Clin Endocrinol Metab. 1994 May;78(5):126.
45-Modulation by insulin of follicle-stimulating hormone and luteinizing hormone actions in human granulosa cells of normal and polycystic ovaries. Willis D, Mason H, Gilling- Smith C, Franks S. J Clin Endocrinol Metab. 1996 Jan;81(1):302-9.
46-Stage-specific expression of androgen receptor, follicle-stimulating hormone receptor, and anti-Müllerian hormone type II receptor in single, isolated, human preantral follicles: relevance to polycystic ovaries. Rice S, Ojha K, Whitehead S, Mason H. J Clin Endocrinol Metab. 2007 Mar;92(3):1034-40.
47-In human granulosa cells from small antral follicles, androgen receptor mRNA and androgen levels in follicular fluid correlate with FSH receptor mRNA. Nielsen ME, Rasmussen IA, Kristensen SG, Christensen ST, Møllgård K, Wreford Andersen E, Byskov AG, Andersen C. Mol Hum Reprod. 2011 Jan;17(1):63-70.
48-Cloning of human androgen receptor complementary DNA and localization to the X chromosome. Lubahn DB, Joseph DR, Sullivan PM, Willard HF, French FS, Wilson EM. Science. 1988 Apr 15;240(4850):327-30.
49-Androgen receptor defects: historical, clinical, and molecular perspectives. Quigley CA, De Bellis A, Marschke KB, el-Awady MK, Wilson EM, French FS. Endocr Rev. 1995 Jun;16(3):271-321.
50-Immunohistochemical localization of androgen receptor in the human ovary throughout the menstrual cycle in relation to oestrogen and progesterone receptor expression. Horie K, Takakura K, Fujiwara H, Suginami H, Liao S, Mori T. Hum Reprod. 1992 Feb;7(2):184-90.
51-Intrafollicular paracrine function of ovarian androgen. Hillier SG. J Steroid Biochem. 1987;27(1-3):351-7.
52-Evidence that granulosa cell aromatase induction/activation by follicle-stimulating hormone is an androgen receptor-regulated process in-vitro. Hillier SG, De Zwart FA. Endocrinology. 1981 Oct;109(4):1303-5.
53-Role of androgens in follicle maturation and atresia. Hillier SG, Tetsuka M. Baillieres Clin Obstet Gynaecol. 1997 Jun;11(2):249-60.
54-Androgen levels in adult females: changes with age, menopause, and oophorectomy. Davison SL, Bell R, Donath S, Montalto JG, Davis SR. J Clin Endocrinol Metab. 2005 Jul;90(7):3847-53.
55-Twenty-four-hour mean plasma testosterone concentration declines with age in normal premenopausal women. Zumoff B, Strain GW, Miller LK, Rosner W. J Clin Endocrinol Metab. 1995 Apr;80(4):1429-30.
56-Androgens regulate ovarian follicular development by increasing follicle stimulating hormone receptor and microRNA-125b expression. Sen A, Prizant H, Light A, Biswas A, Hayes E, Lee HJ, Barad D, Gleicher N, Hammes SR. Proc Natl Acad Sci U S A. 2014 Feb 25;111(8):3008-13.
57-Androgens regulate ovarian follicular development by increasing follicle stimulating hormone receptor and microRNA-125b expression. Sen A, Prizant H, Light A, Biswas A, Hayes E, Lee HJ, Barad D, Gleicher N, Hammes SR. Proc Natl Acad Sci U S A. 2014 Feb 25;111(8):3008-13.
58-5alpha-reductase 1 and 2 expression and activity in human ovarian follicles, stroma and corpus luteum as compared to neonatal foreskin. Haning RV, Jr, Tantravahi U, Zhao Q, Hackett RJ, Canick JA. J Steroid Biochem Mol Biol. 1996 Oct;59(2):199-204.
59-5alpha-reductase activity in women with polycystic ovary syndrome. Jakimiuk AJ, Weitsman SR, Magoffin DA. J Clin Endocrinol Metab. 1999 Jul;84(7):2414-8.
60-Sexual hormones in human skin. Zouboulis CC, Chen WC, Thornton MJ, Qin K, Rosenfield R. Horm Metab Res. 2007 Feb;39(2):85-95.
61-Dihydrotestosterone is a peripheral paracrine hormone. Horton R. J Androl. 1992 Jan-Feb;13(1):23-7.
62-The prevalence of polycystic ovaries in patients with congenital adrenal hyperplasia and their close relatives. Hague WM, Adams J, Rodda C, Brook CG, de Bruyn R, Grant DB, Jacobs HS. Clin Endocrinol (Oxf). 1990 Oct;33(4):501-10.
63-Polycystic ovaries in female-to-male transsexuals. Pache TD, Fauser BC. Clin Endocrinol (Oxf). 1993 Dec;39(6):702-3.
64-Relative binding affinity of anabolic-androgenic steroids: comparison of the binding to the androgen receptors in skeletal muscle and in prostate, as well as to sex hormone-binding globulin. Saartok T, Dahlberg E, Gustafsson JA. Endocrinology. 1984 Jun;114(6):2100-6.
65-Neuroendocrine control by kisspeptins: role in metabolic regulation of fertility. Navarro VM, Tena-Sempere M. Nat Rev Endocrinol. 2011 Sep 13;8(1):40-53.
66-Minireview: kisspeptin/neurokinin B/dynorphin (KNDy) cells of the arcuate nucleus: a central node in the control of gonadotropin-releasing hormone secretion. Lehman MN, Coolen LM, Goodman RL. Endocrinology. 2010 Aug;151(8):3479-89.
67-GnRH pulse frequency-dependent differential regulation of LH and FSH gene expression. Thompson IR, Kaiser UB. Mol Cell Endocrinol. 2014 Mar 25;385(1-2):28-35.
68-The frequency of gonadotropin-releasing-hormone stimulation differentially regulates gonadotropin subunit messenger ribonucleic acid expression. Dalkin AC, Haisenleder DJ, Ortolano GA, Ellis TR, Marshall JC. Endocrinology. 1989 Aug;125(2):917-24.
69-The origins and sequelae of abnormal neuroendocrine function in polycystic ovary syndrome. Blank SK, McCartney CR, Marshall JC. Hum Reprod Update. 2006 Jul-Aug;12(4):351-61.
70-Opioidergic regulation of LH pulsatility in women with polycystic ovary syndrome. Berga SL, Yen SS. Clin Endocrinol (Oxf). 1989 Feb;30(2):177-84.
71-Inappropriate secretion of follicle-stimulating hormone and luteinizing hormone in polycystic ovarian disease. Yen SS, Vela P, Rankin J. J Clin Endocrinol Metab. 1970 Apr;30(4):435-42.
72-Determinants of abnormal gonadotropin secretion in clinically defined women with polycystic ovary syndrome. Taylor AE, McCourt B, Martin KA, Anderson EJ, Adams JM, Schoenfeld D, Hall JE. J Clin Endocrinol Metab. 1997 Jul;82(7):2248-56.
73-Hyperfunction of the hypothalamic-pituitary axis in women with polycystic ovarian disease: indirect evidence for partial gonadotroph desensitization. Waldstreicher J, Santoro NF, Hall JE, Filicori M, Crowley WF Jr. J Clin Endocrinol Metab. 1988 Jan;66(1):165-72.
74-Genome-wide association of polycystic ovary syndrome implicates alterations in gonadotropin secretion in European ancestry populations. Hayes MG, Urbanek M, Ehrmann DA, Armstrong LL, Lee JY, Sisk R, Karaderi T, Barber TM, McCarthy MI, Franks S,Lindgren CM, Welt CK, Diamanti-Kandarakis E, Panidis D, Goodarzi MO, Azziz R, Zhang Y, James RG, Olivier M,Kissebah AH; Reproductive Medicine Network, Stener-Victorin E, Legro RS, Dunaif A. Nat Commun. 2015 Aug 18;6:7502.
75-Metabolic regulation of androgen production by human thecal cells in vitro. Nahum R, Thong KJ, Hillier SG. Hum Reprod. 1995 Jan;10(1):75-81.
76-Increased protein expression of LHCG receptor and 17α-hydroxylase/17-20-lyase in human polycystic ovaries. Comim FV, Teerds K, Hardy K, Franks S. Hum Reprod. 2013 Nov;28(11):3086-92.
77-Developmental programming: rescuing disruptions in preovulatory follicle growth and steroidogenesis from prenatal testosterone disruption. Veiga-Lopez A, Moeller J, Abbott DH, Padmanabhan V. J Ovarian Res. 2016 Jun 29;9(1):39.
78-Thecal cell sensitivity to luteinizing hormone and insulin in polycystic ovarian syndrome. Cadagan D, Khan R, Amer S. Reprod Biol. 2016 Mar;16(1):53-60.
79-Current concepts of the roles of follicle stimulating hormone and luteinizing hormone in folliculogenesis. Hillier SG. Hum Reprod. 1994 Feb;9(2):188-91.
80-Cellular aspects of pre-ovulatory folliculogenesis in primate ovaries. Hillier SG, Harlow CR, Shaw HJ, Wickings EJ, Dixson AF, Hodges JK. Hum Reprod. 1988 May;3(4):507-11.
81-Intrafollicular paracrine function of ovarian androgen. Hillier SG. J Steroid Biochem. 1987;27(1-3):351-7.
82-Circulating luteinizing hormone pulse frequency in women with polycystic ovary syndrome. Kazer RR, Kessel B, Yen SS. J Clin Endocrinol Metab. 1987 Aug;65(2):233-6.
83-Activation of A-type gamma-aminobutyric acid receptors excites gonadotropin-releasing hormone neurons. DeFazio RA, Heger S, Ojeda SR, Moenter SM. Mol Endocrinol. 2002 Dec;16(12):2872-91.
84-Elevated prenatal anti-Müllerian hormone reprograms the fetus and induces polycystic ovary syndrome in adulthood. Tata B, Mimouni NEH, Barbotin AL, Malone SA, Loyens A, Pigny P, Dewailly D, Catteau-Jonard S,Sundström-Poromaa I, Piltonen TT, Dal Bello F, Medana C, Prevot V, Clasadonte J, Giacobini P. Nat Med. 2018 Jun;24(6):834-846.
85-The neuroendocrine genesis of polycystic ovary syndrome: A role for arcuate nucleus GABA neurons. Moore AM, Campbell RE. J Steroid Biochem Mol Biol. 2016 Jun;160:106-17.
86-Depolarising and hyperpolarising actions of GABA(A) receptor activation on gonadotrophin-releasing hormone neurones: towards an emerging consensus. Herbison AE, Moenter SM. J Neuroendocrinol. 2011 Jul;23(7):557-69.
87-Polycystic ovary syndrome: evidence for reduced sensitivity of the gonadotropin-releasing hormone pulse generator to inhibition by estradiol and progesterone. Pastor CL, Griffin-Korf ML, Aloi JA, Evans WS, Marshall JC. J Clin Endocrinol Metab. 1998 Feb;83(2):582-90.
88-Progesterone inhibition of the hypothalamic gonadotropin-releasing hormone pulse generator: evidence for varied effects in hyperandrogenemic adolescent girls. Chhabra S, McCartney CR, Yoo RY, Eagleson CA, Chang RJ, Marshall JC. J Clin Endocrinol Metab. 2005 May;90(5):2810-5.
89-Increased cerebrospinal fluid levels of GABA, testosterone and estradiol in women with polycystic ovary syndrome. Kawwass JF, Sanders KM, Loucks TL, Rohan LC, Berga SL. Hum Reprod. 2017 Jul 1;32(7):1450-1456.
90-Kisspeptins and reproduction: physiological roles and regulatory mechanisms. Pinilla L, Aguilar E, Dieguez C, Millar RP, Tena-Sempere M. Physiol Rev. 2012 Jul;92(3):1235-316.
91-Kisspeptin signaling in the brain. Oakley AE, Clifton DK, Steiner RA. Endocr Rev. 2009 Oct;30(6):713-43.
92-Neuroendocrine control by kisspeptins: role in metabolic regulation of fertility. Navarro VM, Tena-Sempere M. Nat Rev Endocrinol. 2011 Sep 13;8(1):40-53.
93-Minireview: kisspeptin/neurokinin B/dynorphin (KNDy) cells of the arcuate nucleus: a central node in the control of gonadotropin-releasing hormone secretion. Lehman MN, Coolen LM, Goodman RL. Endocrinology. 2010 Aug;151(8):3479-89.
94-Hypertrophy and increased kisspeptin gene expression in the hypothalamic infundibular nucleus of postmenopausal women and ovariectomized monkeys. Rometo AM, Krajewski SJ, Voytko ML, Rance NE. J Clin Endocrinol Metab. 2007 Jul;92(7):2744-50.
95-The kisspeptin system of the human hypothalamus: sexual dimorphism and relationship with gonadotropin-releasing hormone and neurokinin B neurons. Hrabovszky E, Ciofi P, Vida B, Horvath MC, Keller E, Caraty A, Bloom SR, Ghatei MA, Dhillo WS, Liposits Z, Kallo I. Eur J Neurosci. 2010 Jun;31(11):1984-98.
96-Neurokinin B Receptor Antagonism in Women With Polycystic Ovary Syndrome: A Randomized, Placebo-Controlled Trial. George JT, Kakkar R, Marshall J, Scott ML, Finkelman RD, Ho TW, Veldhuis J, Skorupskaite K, Anderson RA, McIntosh S, Webber L. J Clin Endocrinol Metab. 2016 Nov;101(11):4313-4321.
97-Population Pharmacokinetic and Pharmacodynamic Modeling of AZD4901 and Simulation to Support Dose Selection for the Phase 2a Study. Xu H, Li J, Webber L, Kakkar R, Chen Y, Al-Huniti N. J Clin Pharmacol. 2016 Aug;56(8):999-1008.
98-Polycystic ovarian syndrome: evidence that flutamide restores sensitivity of the gonadotropin-releasing hormone pulse generator to inhibition by estradiol and progesterone. Eagleson CA, Gingrich MB, Pastor CL, Arora TK, Burt CM, Evans WS, Marshall JC. J Clin Endocrinol Metab. 2000 Nov;85(11):4047-52.
99-Ontogeny and reversal of brain circuit abnormalities in a preclinical model of PCOS. Silva MS, Prescott M, Campbell RE. JCI Insight. 2018 Apr 5;3(7).
100-Polycystic ovary syndrome: a complex condition with psychological, reproductive and metabolic manifestations that impacts on health across the lifespan. Teede H, Deeks A, Moran L. BMC Med. 2010 Jun 30;8:41.
101-Intrauterine insemination: a UK survey on the adherence to NICE clinical guidelines by fertility clinics. Kim D, Child T, Farquhar C. BMJ Open. 2015 May 15;5(5):e007588.
102-Intrauterine insemination with ovarian stimulation versus expectant management for unexplained infertility (TUI): a pragmatic, open-label, randomised, controlled, two-centre trial. Farquhar CM, Liu E, Armstrong S, Arroll N, Lensen S, Brown J. Lancet. 2018 Feb 3;391(10119):441-450.
103-Prevention of multiple pregnancies in couples with unexplained or mild male subfertility: randomised controlled trial of in vitro fertilisation with single embryo transfer or in vitro fertilisation in modified natural cycle compared with intrauterine insemination with controlled ovarian hyperstimulation. Bensdorp AJ, Tjon-Kon-Fat RI, et al. BMJ. 2015 Jan 9;350:g7771.
104-Is IVF-served two different ways-more cost-effective than IUI with controlled ovarian hyperstimulation? Tjon-Kon-Fat RI, Bensdorp AJ, et al. Hum Reprod. 2015 Oct;30(10):2331-9.
105-IUI: review and systematic assessment of the evidence that supports global recommendations. Cohlen B, Bijkerk A, Van der Poel S, Ombelet W. Hum Reprod Update. 2018 May 1;24(3):300-319.
106-Low-dose FSH therapy for anovulatory infertility associated with polycystic ovary syndrome: rationale, results, reflections and refinements. Homburg R, Howles CM. Hum Reprod Update. 1999 Sep-Oct;5(5):493-9.
107-High singleton live birth rate confirmed after ovulation induction in women with anovulatory polycystic ovary syndrome: validation of a prediction model for clinical practice. Veltman-Verhulst SM, Fauser BC, Eijkemans MJ. Fertil Steril. 2012 Sep;98(3):761-768.e1.
108-PCOS and pregnancy: a review of available therapies to improve the outcome of pregnancy in women with polycystic ovary syndrome. Artini PG, Obino MER, Sergiampietri C, Pinelli S, Papini F, Casarosa E, Cela V. Expert Rev Endocrinol Metab. 2018 Mar;13(2):87-98.
109-Clomiphene citrate and intrauterine insemination: analysis of more than 4100 cycles. Dovey S, Sneeringer RM, Penzias AS. Fertil Steril. 2008 Dec;90(6):2281-6.
110- affecting the pregnancy rate in clomiphene citrate induction of ovulation. Hammond MG, Halme JK, Talbert LM. Obstet Gynecol. 1983 Aug;62(2):196-202.
111-Clomiphene citrate–end of an era? A mini-review. Homburg R. Hum Reprod. 2005 Aug;20(8):2043-51.
112-112-Double-blind randomized controlled trial of letrozole versus clomiphene citrate in subfertile women with polycystic ovarian syndrome. Amer SA, Smith J, Mahran A, Fox P, Fakis A. Hum Reprod. 2017 Aug 1;32(8):1631-1638.
113-Treatment strategies for women with WHO group II anovulation: systematic review and network meta-analysis. Wang R, Kim BV, van Wely M, Johnson NP, Costello MF, Zhang H, Ng EH, Legro RS, Bhattacharya S, Norman RJ, Mol BW. BMJ. 2017 Jan 31;356:j138.
114-Utility of screening for other causes of infertility in women with “known” polycystic ovary syndrome. McGovern PG, Legro RS, Myers ER, Barnhart HX, Carson SA, Diamond MP, Carr BR, Schlaff WD, Coutifaris C, Steinkampf MP, Nestler JE, Gosman G, Leppert PC, Giudice LC; National Institutes for Child Health and Human Development-Reproductive Medicine Network. Fertil Steril. 2007 Feb;87(2):442-4.
115-The basic fertility workup in women with polycystic ovary syndrome: a systematic review. Nahuis MJ, Oosterhuis GJ, Hompes PG, van Wely M, Mol BW, van der Veen F. Fertil Steril. 2013 Jul;100(1):219-25.
116-The male factor in fertility and infertility. IV. Sperm morphology in fertile and infertile marriage. MacLEOD J, GOLD RZ. Fertil Steril. 1951 Sep-Oct;2(5):394-414.
117-The male factor in fertility and infertility. III. An analysis of motile activity in the spermatozoa of 1000 fertile men and 1000 men in infertile marriage. MACLEOD J, GOLD RZ. Fertil Steril. 1951 May-Jun;2(3):187-204.
118-Intracytoplasmic sperm injection and fetal origins of autism spectrum disorder: an intriguing, though controversial association. Briana DD, Malamitsi-Puchner A. J Matern Fetal Neonatal Med. 2020 Feb 20:1-7.
119-DNA methylation differences between in vitro- and in vivo-conceived children are associated with ART procedures rather than infertility. Song S, Ghosh J, Mainigi M, Turan N, Weinerman R, Truongcao M, Coutifaris C, Sapienza C. Clin Epigenetics. 2015 Apr 8;7(1):41.
120-Infertility Treatments and Long-Term Neurologic Morbidity of the Offspring. Levin S, Sheiner E, Wainstock T, Walfisch A, Segal I, Landau D, Sergienko R, Levitas E, Harlev A. Am J Perinatol. 2019 Jul;36(9):949-954.
121-DNA methylation and gene expression differences in children conceived in vitro or in vivo. Katari S, Turan N, Bibikova M, Erinle O, Chalian R, Foster M, Gaughan JP, Coutifaris C, Sapienza C. Hum Mol Genet. 2009 Oct 15;18(20):3769-78.
122-Are imprinting disorders more prevalent after human in vitro fertilization or intracytoplasmic sperm injection? Vermeiden JP, Bernardus RE. Fertil Steril. 2013 Mar 1;99(3):642-51.
123-Embryo manipulation and imprinting. Marchesi DE, Qiao J, Feng HL. Semin Reprod Med. 2012 Aug;30(4):323-34.
124-A systematic review and meta-analysis of DNA methylation levels and imprinting disorders in children conceived by IVF/ICSI compared with children conceived spontaneously. Lazaraviciute G, Kauser M, Bhattacharya S, Haggarty P, Bhattacharya S. Hum Reprod Update. 2014 Nov-Dec;20(6):840-52.
125-Association of assisted reproductive technology (ART) treatment and parental infertility diagnosis with autism in ART-conceived children. Kissin DM, Zhang Y, Boulet SL, Fountain C, Bearman P, Schieve L, Yeargin-Allsopp M, Jamieson DJ. Hum Reprod. 2015 Feb;30(2):454-65.
126-Genetic and epigenetic risks of assisted reproduction. Jiang Z, Wang Y, Lin J, Xu J, Ding G, Huang H. Best Pract Res Clin Obstet Gynaecol. 2017 Oct;44:90-104.
127-Birth defects and congenital health risks in children conceived through assisted reproduction technology (ART): a meeting report. ESHRE Capri Workshop Group. J Assist Reprod Genet. 2014 Aug;31(8):947-58.
128-The epigenetic control of transposable elements and imprinted genes in newborns is affected by the mode of conception: ART versus spontaneous conception without underlying infertility. Choux C, Binquet C, Carmignac V, Bruno C, Chapusot C, Barberet J, Lamotte M, Sagot P, Bourc’his D, Fauque P. Hum Reprod. 2018 Feb 1;33(2):331-340.
129-Association of birth defects with the mode of assisted reproductive technology in a Chinese data-linkage cohort. Yu HT, Yang Q, Sun XX, Chen GW, Qian NS, Cai RZ, Guo HB, Wang CF. Fertil Steril. 2018 May;109(5):849-856.
130-CDC analysis of ICSI/autism: association is not causation.Barad DH, Kushnir VA, Albertini D, Gleicher N. Hum Reprod. 2015 Jul;30(7):1745-6.
131-Reply: CDC analysis of ICSI/autism: association is not causation. Kissin DM, Zhang Y, Boulet SL, Fountain C, Bearman P, Schieve L, Yeargin-Allsopp M, Jamieson DJ. Hum Reprod. 2015 Jul;30(7):1746.
132-Reassurance from Sweden about autism and IVF. BMJ. 2013 Jul 3;347:f4239.
133-DNA methylation status of imprinted H19 and KvDMR1 genes in human placentas after conception using assisted reproductive technology. Chi F, Zhao M, Li K, Lin AQ, Li Y, Teng X. Ann Transl Med. 2020 Jul;8(14):854.
134-The hypomethylation of imprinted genes in IVF/ICSI placenta samples is associated with concomitant changes in histone modifications. Choux C, Petazzi P, Sanchez-Delgado M, Hernandez Mora JR, Monteagudo A, Sagot P, Monk D, Fauque P. Epigenetics. 2020 Dec;15(12):1386-1395.
135-Conception by fertility treatment and offspring deoxyribonucleic acid methylation. Yeung EH, Mendola P, Sundaram R, Zeng X, Guan W, Tsai MY, Robinson SL, Stern JE, Ghassabian A, Lawrence D, O’Connor TG, Segars J, Gore-Langton RE, Bell EM. Fertil Steril. 2021 Apr 3:S0015-0282(21)00216-8.
136-Time to re-evaluate ART protocols in the light of advances in knowledge about methylation and epigenetics: an opinion paper. Menezo Y, Dale B, Elder K. Hum Fertil (Camb). 2018 Sep;21(3):156-162.
137-DNA methylation differences at birth after conception through ART. Tobi EW, Almqvist C, Hedman A, Andolf E, Holte J, Olofsson JI, Wramsby H, Wramsby M, Pershagen G, Heijmans BT, Iliadou AN. Hum Reprod. 2021 Jan 1;36(1):248-259.
138-Do assisted reproductive technologies and in vitro embryo culture influence the epigenetic control of imprinted genes and transposable elements in children? Barberet J, Binquet C, Guilleman M, Doukani A, Choux C, Bruno C, Bourredjem A, Chapusot C, Bourc’his D, Duffourd Y, Fauque P. Hum Reprod. 2021 Jan 25;36(2):479-492.
139-Methylation: An Ineluctable Biochemical and Physiological Process Essential to the Transmission of Life. Menezo Y, Clement P, Clement A, Elder K. Int J Mol Sci. 2020 Dec 7;21(23):9311.
140-The impact of maternal lifestyle factors on periconception outcomes: a systematic review of observational studies. Oostingh EC, Hall J, Koster MPH, Grace B, Jauniaux E, Steegers-Theunissen RPM. Reprod Biomed Online. 2019 Jan;38(1):77-94.
141-Lifestyle factors and reproductive health: taking control of your fertility. Sharma R, Biedenharn KR, Fedor JM, Agarwal A. Reprod Biol Endocrinol. 2013 Jul 16;11:66.
142-Modifiable Risk Factors and Infertility: What are the Connections? Rossi BV, Abusief M, Missmer SA. Am J Lifestyle Med. 2014;10(4):220-231.
143-Preconception lifestyle advice for people with subfertility. Anderson K, Norman RJ, Middleton P. Cochrane Database Syst Rev. 2010 Apr 14;(4):CD008189.
144- influence of maternal and paternal factors on time to pregnancy–a Dutch population-based birth-cohort study: the GECKO Drenthe study. Mutsaerts MA, Groen H, Huiting HG, Kuchenbecker WK, Sauer PJ, Land JA, Stolk RP, Hoek A. Hum Reprod. 2012 Feb;27(2):583-93.
145-Effects of age, cigarette smoking, and other factors on fertility: findings in a large prospective study. Howe G, Westhoff C, Vessey M, Yeates D. Br Med J (Clin Res Ed). 1985 Jun 8;290(6483):1697-700.
146-Smoking and female infertility: a systematic review and meta-analysis. Augood C, Duckitt K, Templeton AA. Hum Reprod. 1998 Jun;13(6):1532-9.
147-Delayed conception and active and passive smoking. The Avon Longitudinal Study of Pregnancy and Childhood Study Team. Hull MG, North K, Taylor H, Farrow A, Ford WC. Fertil Steril. 2000 Oct;74(4):725-33.
148-An epidemiologic study of smoking and primary infertility in women. Laurent SL, Thompson SJ, Addy C, Garrison CZ, Moore EE. Fertil Steril. 1992 Mar;57(3):565-72.
149-Tobacco use, alcohol consumption and infertility. Olsen J, Rachootin P, Schiødt AV, Damsbo N. Int J Epidemiol. 1983 Jun;12(2):179-84.
150-Smoking reduces fecundity: a European multicenter study on infertility and subfecundity. The European Study Group on Infertility and Subfecundity. Bolumar F, Olsen J, Boldsen J. Am J Epidemiol. 1996 Mar 15;143(6):578-87.
151-Does cigarette smoking impair natural or assisted fecundity? Hughes EG, Brennan BG. Fertil Steril. 1996 Nov;66(5):679-89.
152-Active and passive smoking and fecundability in Danish pregnancy planners. Radin RG, Hatch EE, Rothman KJ, Mikkelsen EM, Sørensen HT, Riis AH, Wise LA. Fertil Steril. 2014 Jul;102(1):183-191.
153-Effects of cigarette smoking, caffeine consumption, and alcohol intake on fecundability. Curtis KM, Savitz DA, Arbuckle TE. Am J Epidemiol. 1997 Jul 1;146(1):32-41.
154-Scrambled and fried: cigarette smoke exposure causes antral follicle destruction and oocyte dysfunction through oxidative stress. Sobinoff AP, Beckett EL, Jarnicki AG, Sutherland JM, McCluskey A, Hansbro PM, McLaughlin EA. Toxicol Appl Pharmacol. 2013 Sep 1;271(2):156-67.
155-Cigarette smoke exposure leads to follicle loss via an alternative ovarian cell death pathway in a mouse model. Gannon AM, Stämpfli MR, Foster WG. Toxicol Sci. 2012 Jan;125(1):274-84.
156-Cigarette smoke exposure elicits increased autophagy and dysregulation of mitochondrial dynamics in murine granulosa cells. Gannon AM, Stämpfli MR, Foster WG. Biol Reprod. 2013 Mar 14;88(3):63.
157-Cigarette smoke is associated with altered expression of antioxidant enzymes in granulosa cells from women undergoing in vitro fertilization. Budani MC, Carletti E, Tiboni GM. Zygote. 2017 Jun;25(3):296-303.
158-Effect of cigarette smoking on DNA damage of human cumulus cells analyzed by comet assay. Sinkó I, Mórocz M, Zádori J, Kokavszky K, Raskó I. Reprod Toxicol. 2005 May-Jun;20(1):65-71.
159-Prospective study of cigarette smoking and fecundability. Wesselink AK, Hatch EE, Rothman KJ, Mikkelsen EM, Aschengrau A, Wise LA. Hum Reprod. 2019 Mar 1;34(3):558-567.
160-Cigarette smoking may affect meiotic maturation of human oocytes. Zenzes MT, Wang P, Casper RF. Hum Reprod. 1995 Dec;10(12):3213-17.
161-Cigarette smoking and levels of adrenal androgens in postmenopausal women. Khaw KT, Tazuke S, Barrett-Connor E. N Engl J Med. 1988 Jun 30;318(26):1705-9.
162-Placental cadmium and progesterone concentrations in cigarette smokers. Piasek M, Blanusa M, Kostial K, Laskey JW. Reprod Toxicol. 2001 Nov-Dec;15(6):673-81.
163-Effects of in vitro cadmium exposure on ovarian steroidogenesis in rats. Piasek M, Laskey JW. J Appl Toxicol. 1999 May-Jun;19(3):211-7.
164-Components of cigarette smoke inhibit expansion of oocyte-cumulus complexes from porcine follicles. Vrsanská S, Nagyová E, Mlynarcíková A, Ficková M, Kolena J. Physiol Res. 2003;52(3):383-7.
165-Influence of nicotine, cotinine, anabasine and cigarette smoke extract on human granulosa cell progesterone and estradiol synthesis. Gocze PM, Szabo I, Freeman DA. Gynecol Endocrinol. 1999 Aug;13(4):266-72.
166-Ovotoxicity of cigarette smoke: A systematic review of the literature. Budani MC, Tiboni GM. Reprod Toxicol. 2017 Sep;72:164-181.
167-Adult and prenatal exposures to tobacco smoke as risk indicators of fertility among 430 Danish couples. Jensen TK, Henriksen TB, Hjollund NH, Scheike T, Kolstad H, Giwercman A, Ernst E, Bonde JP, Skakkebaek NE, Olsen J. Am J Epidemiol. 1998 Nov 15;148(10):992-7.
168-Reduced fecundability in women with prenatal exposure to cigarette smoking. Weinberg CR, Wilcox AJ, Baird DD. Am J Epidemiol. 1989 May;129(5):1072-8.
169-In utero exposure to tobacco smoke and subsequent reduced fertility in females. Ye X, Skjaerven R, Basso O, Baird DD, Eggesbo M, Cupul Uicab LA, Haug K, Longnecker MP. Hum Reprod. 2010 Nov;25(11):2901-6.
170-Maternal Smoke Exposure Impairs the Long-Term Fertility of Female Offspring in a Murine Model. Camlin NJ, Sobinoff AP, Sutherland JM, Beckett EL, Jarnicki AG, Vanders RL, Hansbro PM, McLaughlin EA, Holt JE. Biol Reprod. 2016 Feb;94(2):39.
171-Smoking, alcohol and caffeine in relation to two hormonal indicators of ovarian age during the reproductive years. Kline J, Tang A, Levin B. Maturitas. 2016 Oct;92:115-122.
172-The impact of smoking on antimüllerian hormone levels in women aged 38 to 50 years. Plante BJ, Cooper GS, Baird DD, Steiner AZ. Menopause. 2010 May-Jun;17(3):571-6.
173-Premenopausal factors influencing premature ovarian failure and early menopause. Chang SH, Kim CS, Lee KS, Kim H, Yim SV, Lim YJ, Park SK. Maturitas. 2007 Sep 20;58(1):19-30.
174-Steroid hormone levels associated with passive and active smoking. Soldin OP, Makambi KH, Soldin SJ, O’Mara DM. Steroids. 2011 Jun;76(7):653-9.
175-Cigarette smoking and testosterone in men and women: A systematic review and meta-analysis of observational studies. Zhao J, Leung JYY, Lin SL, Mary Schooling C. Prev Med. 2016 Apr;85:1-10.
176-Cigarette smoking, steroid hormones, and bone mineral density in young women. Daniel M, Martin AD, Drinkwater DT. Calcif Tissue Int. 1992 Apr;50(4):300-5.
177-Smoking in infertile women with polycystic ovary syndrome: baseline validation of self-report and effects on phenotype. Legro RS, Chen G, Kunselman AR, Schlaff WD, Diamond MP, Coutifaris C, Carson SA, Steinkampf MP, Carr BR, McGovern PG, Cataldo NA, Gosman GG, Nestler JE, Myers ER, Zhang H, Foulds J; Reproductive Medicine Network. Hum Reprod. 2014 Dec;29(12):2680-6.
178-Effect of exposure to second-hand smoke from husbands on biochemical hyperandrogenism, metabolic syndrome and conception rates in women with polycystic ovary syndrome undergoing ovulation induction. Li J, Wu Q, Wu XK, Zhou ZM, Fu P, Chen XH, Yan Y, Wang X, Yang ZW, Li WL, Stener-Victorin E, Legro RS, Ng EH, Zhang H, Mol BWJ, Wang CC; for PCOSAct Study Group. Hum Reprod. 2018 Apr 1;33(4):617-625.
179-In vitro exposure to environmental tobacco smoke induces CYP1B1 expression in human luteinized granulosa cells. Vidal JD, VandeVoort CA, Marcus CB, Lazarewicz NR, Conley AJ. Reprod Toxicol. 2006 Nov;22(4):731-7.
180-Time to menopause in relation to PBBs, PCBs, and smoking. Blanck HM, Marcus M, Tolbert PE, Schuch C, Rubin C, Henderson AK, Zhang RH, Hertzberg VS. Maturitas. 2004 Oct 15;49(2):97-106.
181-The ability of polycyclic aromatic hydrocarbons to alter physiological factors underlying drug disposition. Elsherbiny ME, Brocks DR. Drug Metab Rev. 2011 Nov;43(4):457-75.
182-Increased 2-hydroxylation of estradiol as a possible mechanism for the anti-estrogenic effect of cigarette smoking. Michnovicz JJ, Hershcopf RJ, Naganuma H, Bradlow HL, Fishman J. N Engl J Med. 1986 Nov 20;315(21):1305-9.
183-Effect of cadmium on morphology and steroidogenesis of cultured human ovarian granulosa cells. Paksy K, Rajczy K, Forgács Z, Lázár P, Bernard A, Gáti I, Kaáli GS. J Appl Toxicol. 1997 Sep-Oct;17(5):321-7.
184-Effects of nicotine on human luteal cells in vitro: a possible role on reproductive outcome for smoking women. Miceli F, Minici F, Tropea A, Catino S, Orlando M, Lamanna G, Sagnella F, Tiberi F, Bompiani A, Mancuso S, Lanzone A, Apa R. Biol Reprod. 2005 Mar;72(3):628-32.
185-Direct effects of nicotine on the meiotic maturation of hamster oocytes. Racowsky C, Hendricks RC, Baldwin KV. Reprod Toxicol. 1989;3(1):13-21.
186-Relation between smoking and age of natural menopause. Report from the Boston Collaborative Drug Surveillance Program, Boston University Medical Center. Jick H, Porter J. Lancet. 1977 Jun 25;1(8026):1354-5.
187-Smoking and age at menopause in women. McKinlay SM, Bifano NL, McKinlay JB. Ann Intern Med. 1985 Sep;103(3):350-6.
188-Constituents of cigarette smoke inhibit human granulosa cell aromatase. Barbieri RL, McShane PM, Ryan KJ. Fertil Steril. 1986 Aug;46(2):232-6.
189-InterLACE: A New International Collaboration for a Life Course Approach to Women’s Reproductive Health and Chronic Disease Events. Mishra GD, Anderson D, Schoenaker DA, Adami HO, Avis NE, Brown D, Bruinsma F, Brunner E, Cade JE, Crawford SL, Dobson AJ, Elliott J, Giles GG, Gold EB, Hayashi K, Kuh D, Lee KA, Lee JS, Melby MK, Mizunuma H, Sievert LL, Weiderpass E. Maturitas. 2013 Mar;74(3):235-40.
190-The InterLACE study: Design, data harmonization and characteristics across 20 studies on women’s health. Mishra GD, Chung HF, Pandeya N, Dobson AJ, Jones L, Avis NE, Crawford SL, Gold EB, Brown D, Sievert LL, Brunner E, Cade JE, Burley VJ, Greenwood DC, Giles GG, Bruinsma F, Goodman A, Hayashi K, Lee JS, Mizunuma H, Kuh D, Cooper R, Hardy R, Obermeyer CM, Lee KA, Simonsen MK, Yoshizawa T, Woods NF, Mitchell ES, Hamer M, Demakakos P, Sandin S, Adami HO, Weiderpass E, Anderson D. Maturitas. 2016 Oct;92:176-185.
191-The antiestrogenic effect of cigarette smoking in women. Baron JA, La Vecchia C, Levi F. Am J Obstet Gynecol. 1990 Feb;162(2):502-14.
192-Relationships between intensity, duration, cumulative dose, and timing of smoking with age at menopause: A pooled analysis of individual data from 17 observational studies. Zhu D, Chung HF, Pandeya N, Dobson AJ, Cade JE, Greenwood DC, Crawford SL, Avis NE, Gold EB, Mitchell ES, Woods NF, Anderson D, Brown DE, Sievert LL, Brunner EJ, Kuh D, Hardy R, Hayashi K, Lee JS, Mizunuma H, Giles GG, Bruinsma F, Tillin T, Simonsen MK, Adami HO, Weiderpass E, Canonico M, Ancelin ML, Demakakos P, Mishra GD. PLoS Med. 2018 Nov 27;15(11):e1002704.
193-Smoke, alcohol and drug addiction and female fertility. de Angelis C, Nardone A, Garifalos F, Pivonello C, Sansone A, Conforti A, Di Dato C, Sirico F, Alviggi C, Isidori A, Colao A, Pivonello R. Reprod Biol Endocrinol. 2020 Mar 12;18(1):21.
194-Looking Inside the World of Granulosa Cells: The Noxious Effects of Cigarette Smoke. Konstantinidou F, Stuppia L, Gatta V. Biomedicines. 2020 Aug 27;8(9):309.
195-Smoking and reproduction: gene damage to human gametes and embryos. Zenzes MT. Hum Reprod Update. 2000 Mar-Apr;6(2):122-31.
196-Lifestyle and environmental contributions to ovulatory dysfunction in women of polycystic ovary syndrome. Zhang B, Zhou W, Shi Y, Zhang J, Cui L, Chen ZJ. BMC Endocr Disord. 2020 Jan 30;20(1):19.
197-Cigarette, alcohol, and coffee consumption and spontaneous abortion. Armstrong BG, McDonald AD, Sloan M. Am J Public Health. 1992 Jan;82(1):85-7.
198-Cigarette smoking and the risk of natural menopause. Midgette AS, Baron JA. Epidemiology. 1990 Nov;1(6):474-80.
199-Smoking and corpus luteum function. Bódis J, Hanf V, Török A, Tinneberg HR. Fertil Steril. 1992 Mar;57(3):703.
200-Cigarette smoking and urinary estrogens. MacMahon B, Trichopoulos D, Cole P, Brown J. N Engl J Med. 1982 Oct 21;307(17):1062-5.
201-Smoking out the oestrogens. Shulman A, Ellenbogen A, Maymon R, Bahary C. Hum Reprod. 1990 Apr;5(3):231-3.
202-Spontaneous pregnancies among couples previously treated by in vitro fertilization. Troude P, Bailly E, Guibert J, Bouyer J, de la Rochebrochard E; DAIFI Group. Fertil Steril. 2012 Jul;98(1):63-8.
203-The long-term outcome of 946 consecutive couples visiting a fertility clinic in 2001-2003. Donckers J, Evers JL, Land JA. Fertil Steril. 2011 Jul;96(1):160-4.
204-Spontaneous conceptions within two years of having a first infant with assisted conception. Wynter K, McMahon C, Hammarberg K, McBain J, Boivin J, Gibson F, Fisher J. Aust N Z J Obstet Gynaecol. 2013 Oct;53(5):471-6.
205-Live birth outcome, spontaneous pregnancy and adoption up to five years after undergoing assisted reproductive technology treatment. Volgsten H, Schmidt L. Acta Obstet Gynecol Scand. 2017 Aug;96(8):954-959.
206-Spontaneous conceptions following successful ART are not associated with premature referral. Lande Y, Seidman DS, Maman E, Baum M, Dor J, Hourvitz A. Hum Reprod. 2012 Aug;27(8):2380-3.
207-Outcome of assisted reproductive technology (ART) and subsequent self-reported life satisfaction. Kuivasaari-Pirinen P, Koivumaa-Honkanen H, Hippeläinen M, Raatikainen K, Heinonen S. PLoS One. 2014 Nov 13;9(11):e112540.
208-Female alcohol consumption and fecundability: a systematic review and dose-response meta-analysis. Fan D, Liu L, Xia Q, Wang W, Wu S, Tian G, Liu Y, Ni J, Wu S, Guo X, Liu Z. Sci Rep. 2017 Oct 23;7(1):13815.
209-Effects of alcohol consumption on female fertility during an 18-year period. Eggert J, Theobald H, Engfeldt P. Fertil Steril. 2004 Feb;81(2):379-83.
210-Drinking and reproductive dysfunction among women in a 1981 national survey. Wilsnack SC, Klassen AD, Wilsnack RW. Alcohol Clin Exp Res. 1984 Sep-Oct;8(5):451-8.
211-Infertility in women and moderate alcohol use. Grodstein F, Goldman MB, Cramer DW. Am J Public Health. 1994 Sep;84(9):1429-32.
212-Alcohol and caffeine consumption and decreased fertility. Hakim RB, Gray RH, Zacur H. Fertil Steril. 1998 Oct;70(4):632-7.
213-Does moderate alcohol consumption affect fertility? Follow up study among couples planning first pregnancy. Jensen TK, Hjollund NH, Henriksen TB, Scheike T, Kolstad H, Giwercman A, Ernst E, Bonde JP, Skakkebaek NE, Olsen J. BMJ. 1998 Aug 22;317(7157):505-10.
214-Alcohol use as predictor for infertility in a representative population of Danish women. Tolstrup JS, Kjaer SK, Holst C, Sharif H, Munk C, Osler M, Schmidt L, Andersen AM, Grønbaek M. Acta Obstet Gynecol Scand. 2003 Aug;82(8):744-9.
215-Factors affecting time to pregnancy. Axmon A, Rylander L, Albin M, Hagmar L. Hum Reprod. 2006 May;21(5):1279-84.
216-Effect of alcohol on the proestrous surge of luteinizing hormone (LH) and the activation of LH-releasing hormone (LHRH) neurons in the female rat. Ogilvie KM, Rivier C. J Neurosci. 1997 Apr 1;17(7):2595-604.
217-Ethanol has direct inhibitory effects on steroidogenesis in human granulosa cells: specific inhibition of LH action. Saxena S, Meehan D, Coney P, Wimalasena J. Alcohol Clin Exp Res. 1990 Aug;14(4):522-7.
218-Selective inhibition of luteinizing hormone action by ethanol in cultured human granulosa cells. Wimalasena J, Meehan D, Dostal R, de Silva M. Alcohol Clin Exp Res. 1993 Apr;17(2):340-4.
219-Chronic alcohol effects on anterior pituitary and ovarian hormones in healthy women. Mendelson JH, Mello NK. J Pharmacol Exp Ther. 1988 May;245(2):407-12.
220-Alcohol effects on luteinizing hormone releasing hormone-stimulated anterior pituitary and gonadal hormones in women. Mendelson JH, Mello NK, Teoh SK, Ellingboe J. J Pharmacol Exp Ther. 1989 Sep;250(3):902-9.
221-Acute alcohol effects on plasma estradiol levels in women. Mendelson JH, Lukas SE, Mello NK, Amass L, Ellingboe J, Skupny A. Psychopharmacology (Berl). 1988;94(4):464-7.
222-Alcohol effects on naloxone-stimulated luteinizing hormone, prolactin and estradiol in women. Mendelson JH, Mello NK, Cristofaro P, Ellingboe J, Skupny A, Palmieri SL, Benedikt R, Schiff I. J Stud Alcohol. 1987 Jul;48(4):287-94.
223-Alcohol and Puberty. Dees WL, Hiney JK, Srivastava VK. Alcohol Res. 2017;38(2):277-282.
224-Effects of alcohol consumption on plasma and urinary hormone concentrations in premenopausal women. Reichman ME, Judd JT, Longcope C, Schatzkin A, Clevidence BA, Nair PP, Campbell WS, Taylor PR. J Natl Cancer Inst. 1993 May 5;85(9):722-7.
225-Acute effect of alcohol on estradiol, estrone, progesterone, prolactin, cortisol, and luteinizing hormone in premenopausal women. Sarkola T, Mäkisalo H, Fukunaga T, Eriksson CJ. Alcohol Clin Exp Res. 1999 Jun;23(6):976-82.
226-The effect of progesterone and FSH and LH response to LHRH in normal women. Shaw RW, et al. Clin Endocrinol (Oxf). 1975.
227-Progesterone modulation of pulsatile luteinizing hormone secretion in normal women. Soules MR, Steiner RA, Clifton DK, Cohen NL, Aksel S, Bremner WJ. J Clin Endocrinol Metab. 1984 Feb;58(2):378-83.
228-Induction of midcycle gonadotropin surge by ovarian steroids in women: a critical evaluation. Liu JH, Yen SS. J Clin Endocrinol Metab. 1983 Oct;57(4):797-802.
229-Influence of ethanol on the redox state of the liver. Forsander OA. Q J Stud Alcohol. 1970 Sep;31(3):550-70.
230-Physiology and molecular genetics of 17 beta-hydroxysteroid dehydrogenases. Andersson S, Moghrabi N. Steroids. 1997 Jan;62(1):143-7.
 Polikistik Over
Polikistik Over
