Kadınlarda görülen saç dökülmesine en çok erkeklik hormonları (testosteron, dihidrotestosteron) neden olmaktadır(272,273,274,281). Erkeklik hormonları (androgen) saçlı deri dışındaki bölgelerde kılların büyümesine neden olurken, tam tersine saçlı deride ise kılların dökülmesine neden olmaktadır(275,276,281). Erkeklik hormonlarına bağlı saç dökülmesi (alopecia) olan kadınların büyük kısmında polikistik over sendromu vardır(277,278,279,280, 285,290). Bu kadınların ailelerinin diğer üyelerinde de erkeklik hormonlarına bağlı saç dökülmesi daha fazla görülmektedir(284,287). Erkeklik hormonlarının neden olduğu saç dökülmesi (Female Pattern Hair Loss) ergenlik döneminden itibaren görülmeye başlar, 35-40 yaşlarında daha sık görülür ve menopoz sonrası dönemde de görülme sıklığı artarak devam eder(282,283,284).
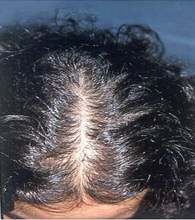
Kadınlarda erkeklik hormonlarına bağlı saç dökülmesi çoğunlukla saçlı derinin orta, taç kısmında görülür. Erkeklerde görülen saç dökülmesinden farklı olarak tepe bölgesi (vertex) ve alnın üst kısmında bulunan saç çizgisinde genellikle dökülme olmaz. Orta alanda başlayan saç dökülmesi ön tarafa (frontal) doğru ilerledikçe yandaki resimde görüldüğü gibi saçların döküldüğü bölgede çam ağacı görüntüsü ortaya çıkar(275,283,284,286). Erkeklik hormonlarına bağlı saç dökülmesi çoğunlukla yavaş bir başlangıç ve yavaş bir ilerleme gösterir. Saçlar kırılmaz sadece kıl köklerinden dökülür. Saç dökülmesinin olduğu bölgede bulunan saçların bir kısmında incelme, yavaş büyüme, küçülme ve renginde soluklaşma 〈Miniaturization〉 görülür(282,283,284). Erkeklik hormonlarına bağlı saç dökülmesi olan kadınların bir kısmında saç dökülmesi ile birlikte tüylenme artışı, sivilce ve adet düzensizliği de vardır(147,277). Fakat, bu kadınların bir kısmında saç dökülmesi tek başına görülmektedir(147,277).
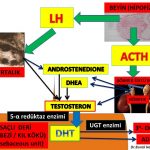
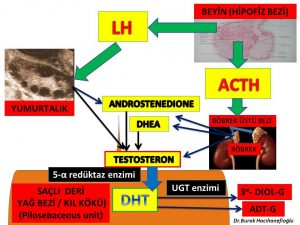
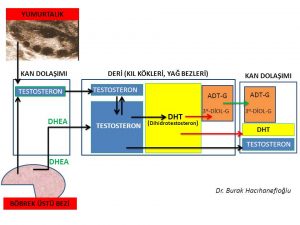
Erkeklik hormonlarına bağlı saç dökülmesi görülen kadınların sadece bir kısmında erkeklik hormonları (testosteron, dihidrotestosteron) ve erkeklik hormonlarına dönüşen hammaddeler (DHEAS, androstenedione) kan dolaşımında fazla miktarlarda (hiperandrogenemia) bulunmaktadır (277,288,289,290,291). Erkeklik hormonlarının (testosteron, dihidrotestosteron) büyük bir kısmı böbrek üstü bezinde (Adrenal Gland) üretilen DHEA (Dehydroepiandrosterone) ve Androstenedione hormonlarını hammadde olarak kullanarak kıl kökleri ve yağ bezlerinin bulunduğu deri gibi aynı zamanda erkeklik hormonlarının (testosteron, dihidrotestosteron) hedefi olan organlarda üretilirken ancak küçük bir kısmı yumurtalık ve böbrek üstü bezinde üretilmektedir (Intracrinology)119,120,292,293).
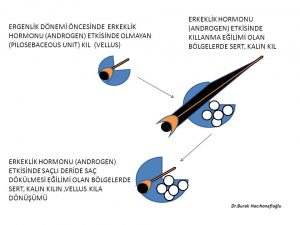
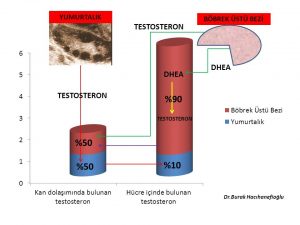
Kan dolaşımında bulunan testosteron miktarı sadece yumurtalık ve böbrek üstü bezinden doğrudan salınan miktarı göstermektedir. Kadınlarda testosteron hormonunun büyük kısmının üretildiği deri, yağ dokusu, meme gibi organlardan ancak küçük bir miktar (%10) testosteron kan dolaşımına girmektedir(294). Kan dolaşımına girmeyen testosteron hormonunun büyük çoğunluğu 5- α reduktaz (reductase) enzimi tarafından testosteron hormonundan 10 kat daha güçlü bir etkiye sahip olan dihidrotestosteron (dhydrotestosterone) hormonuna dönüşmektedir (119,122,123,124,125).
 Dihidrotestosteron hormonunun etkili olabilmesi için ilk olarak erkeklik hormonu alıcısına (androgen receptor) tutunması gerekmektedir(295,296). Erkeklik hormonu alıcıları saçlı deride en çok yağ bezlerinde (sebaceous glands), kıl köklerinde (dermal papilla) ve ter bezlerinde bulunmaktadır(129,130,131). Saçlı deride saç dökülmesi eğilimi olan bölgelerde fazla miktarda erkeklik hormonu alıcısı (androgen receptor) vardır(327). Dihidrotestosteron hormonu bu bölgelerde daha fazla etkili olduğu için saç dökülmesine neden olmaktadır.
Dihidrotestosteron hormonunun etkili olabilmesi için ilk olarak erkeklik hormonu alıcısına (androgen receptor) tutunması gerekmektedir(295,296). Erkeklik hormonu alıcıları saçlı deride en çok yağ bezlerinde (sebaceous glands), kıl köklerinde (dermal papilla) ve ter bezlerinde bulunmaktadır(129,130,131). Saçlı deride saç dökülmesi eğilimi olan bölgelerde fazla miktarda erkeklik hormonu alıcısı (androgen receptor) vardır(327). Dihidrotestosteron hormonu bu bölgelerde daha fazla etkili olduğu için saç dökülmesine neden olmaktadır.
5- α reduktaz (reductase) enziminin 2 formu (isozyme) vardır(297,298). Saçlı deride en fazla 5- α reduktaz (reductase) tip 1 enzimi bulunmaktadır(124, 297,298). Saç dökülmesine neden olan dihidrotestosteron hormonunu üreten 5- α reduktaz (reductase) enzimi saçlı deride saç dökülmesi eğilimi olan yerlerde çok daha fazla miktarda bulunmaktadır(299,300,301). Bu nedenle saç dökülmesi eğilimi olan bölgelerde dihidrotestosteron daha fazla miktarda üretilmektedir(299,300,301). Polikistik over sendromu olan kadınların bir kısmında 5- α reduktaz (reductase) tip 1 enziminin üretimini sağlayan SRD5A1 geninin belirli bölgelerinde genetik farklılıklar (variant) vardır. Bu genetik değişiklikler 5- α reduktaz (reductase) tip 1 enziminin etkinliğini (activity) arttırarak saç dökülmesine neden olmaktadır(302,303,304).
Dihidrotestosteron hormonunun da testosteron hormonu gibi büyük çoğunluğu (%90) kan dolaşımına girmemektedir. Kan dolaşımına girmeyen dihidrotestosteron hormonu üretildiği saçlı deride bulunan kıl köklerinde saç dökülmesine neden olmaktadır (123,305). Saçlı deride üretilen dihidrotestosteron (DHT) hormonunun büyük çoğunluğu deri hücresini korumak amacıyla UGT- enzimi ile herhangi bir hormon etkisi olmayan ürünler (metabolit) olan 3 α- androstanediol glucuronide (3α diol G) ve androsterone Glucuronide (ADT-G) dönüşerek deri hücresinden kan dolaşımına girmektedir(305,306,307,308). Kan dolaşımına katılan 3 α- androstanediol glucuronide (3α diol G) ve androsterone Glucuronide (ADT-G) idrar yolu ile vücuttan atılmaktadır(305,306,307,308).
∗Saç dökülmesi şikayeti olmasına rağmen polikistik over sendromu olan kadınların bir kısmında kan dolaşımında erkeklik hormonları (testosteron ve dihidrotestosteron) normal seviyelerde bulunmaktadır.
Aynı zamanda kan dolaşımında bulunan erkeklik hormonlarının miktarları saç dökülmesinin şiddetiyle paralel olarak da değişmemektedir. Bunun bir nedeni erkeklik hormonlarının büyük bir kısmının kan dolaşımına girmeden saçlı deri hücrelerinde üretilmesidir. Diğer bir nedeni de bu kadınların bir kısmında dihidrotestosteron hormonunu üreten 5- α reduktaz (reductase) enziminin etkinliğinin (activity) doğuştan (genetik) artmış olmasıdır. Polikistik over sendromu’nda erkeklik hormonlarının miktarındaki artışı ve saç dökülmesini değerlendirirken yukarıda anlattığım buz dağının görünmeyen kısmının da olabileceğini unutmamalıyız.
Tedavi;
Uzun etkili ve kalıcı bir tedavi etkinliğinin olmamasına ve bacak damarlarının pıhtı ile tıkanması (derin ven trombozu) ve ordan kopan pıhtı parçasının da akciğer damarlarını tıkaması (pulmoner emboli) ve meme kanseri ihtimalini arttırması gibi bir kısmı hayati tehlikeye sahip olan bir çok yan etkiye sahip olmasına rağmen doğum kontrol hapları saç dökülmesi tedavisinde halen yaygın olarak kullanılmaktadır(309,310,311,312,313,314,315,316).
∗Polikistik over sendromu’nda saç dökülmesi tedavisinde doğum kontrol hapı kullanılması doğru değildir.
Tedavi Yöntemleri;
Polikistik over sendromu’nda sivilce tedavisinde en güçlü erkeklik hormonu olan dihidrotestosteron hormonuna dönüşen erkeklik hormonlarının (testosteron, androstenedione, DHEAS) etkinliğinin ve miktarının azaltılması, dihidrotestosteron hormonuna dönüşümün azaltılması ve Sex Hormon Binding Globulin miktarının arttırılması sonucunda kan dolaşımında serbest bulunan erkeklik hormonlarının etkin formlarının (serbest testosteron) miktarının azaltılması tedavinin temel amacıdır.
1-İnsülin direnci olan kadınlarda insülin duyarlılığının ilaç tedavisi ile arttırılmasına bağlı olarak kan dolaşımında bulunan insülin miktarının azalması yumurtalıkta fazla miktarda üretilen erkeklik hormonlarını (androstenedione, testosteron) azaltmaktadır(317,318). İnsülin direncinin azalması aynı zamanda karaciğerde üretilen SHBG miktarını arttırmakta ve erkeklik hormonlarının serbest dolaşan etkin formlarının (serbest testosteron ) miktarının azalmasına neden olmaktadır(317,318).
2-Kan dolaşımında bulunan erkeklik hormonlarının bir kısmı ve saçlı deride üretilen erkeklik hormonları saçlı deride kıl köklerinde bulunan alıcılara (androgen receptor) tutunarak saç dökülmesine neden olmaktadır. Erkeklik hormonlarının kıl köklerindeki alıcılara tutunmasının engellenmesi (androgen receptor antagonist) diğer bir tedavi seçeneğidir(319,320,321,322). Bu amaçla kullanılan ilaçların (androgen receptor antagonist) doğum kontrol hapları gibi hayati tehlikeye sahip yan etkileri ( bacak damarlarının pıhtı ile tıkanması ve ordan kopan pıhtı parçasının da akciğer damarlarını tıkaması ve meme kanseri) yoktur(323,324,325). 3-Alıcılara (receptor) tutunarak deri hücresine giren testosteron ile saçlı deri hücresinde üretilen testosteron hormonunun büyük çoğunluğu 5- α reduktaz (reductase) enzimi tarafından kıl köklerinde saç dökülmesine neden olan dihidrotestosteron (dhydrotestosterone) hormonuna dönüşmektedir(122,123,124,125). 5- α reduktaz (reductase) enziminin bu etkisinin engellenmesi ( 5- α reductase inhibitor) de bir tedavi seçeneğidir(122,123,124,125). Bu amaçla kullanılan ilaçların ( 5- α reductase inhibitor) doğum kontrol hapları gibi hayati tehlikeye sahip yan etkileri ( bacak damarlarının pıhtı ile tıkanması ve ordan kopan pıhtı parçasının da akciğer damarlarını tıkaması ve meme kanseri) yoktur(326). 4-Saç ekimi (implantation) ve saç nakli (transplantasyon) tedavisinde erkeklik hormonlarına duyarlı olmayan dökülme olmamış bölgelerden (donor) kıl kökleri (folikül) çıkartılarak dökülme olan bölgelere (recipient) yerleştirilir(284,328). Bu nedenle kılların alınacağı dökülme olmamış bölgelerde yeterince kıl olması gerekmektedir(284,328,329). Erkeklik hormonlarının etki etmediği bölgelerden alınan kıl kökleri yerleştirildikleri bölgede de bu özelliklerini sürdürmektedir(284). Bu nedenle nakil sonrasında kıl köklerinin yerleştirildiği bölgelerde erkeklik hormonlarına bağlı dökülme olmamaktadır. Kadınlarda çoğunlukla alın bölgesinde saç çizgisi ve tepe bölgesinde açılma olmadığı için daha çok incelme olan orta alan ve orta alandan öne doğru çam ağacı görüntüsü şeklinde dökülme ve incelme olan bölgelere nakil yapılmaktadır(284,328,329).
Yaygın saç dökülmesi olan kadınlarda kılların alınacağı bölgelerde yeterince kıl olmadığı için suni kıl (biofibre) kullanılarak nakil yapılabilmektedir(330). Erkeklik hormonlarına bağlı saç dökülmesinde nakil için kılların alındığı bölgede (donor) de nakil sonrasında nakil yapılan bölgede (recipient) olduğu gibi saç dökülmesi ihtimali vardır(284,328,329).
∗Saç ekimi (implantation) ve saç nakli (transplantasyon) tedavisi saç dökülmesine neden olan erkeklik hormonları (testosteron, dihidrotestosteron) ve onların hammaddelerinde (DHEA, androstenedion) görülen artışın (hiperandrogenism) ve onların saçlı deri üzerindeki etkilerinin tedavisi ile birlikte uygulandığı zaman faydalı olmaktadır.
Polikistik over sendromu’nda yumurtalıklarda üretilen erkeklik hormonlarının (testosteron gibi) büyük bir kısmı yumurtalıkların dış kısmında (korteks) üretilmektedir(87,149).
Polikistik over sendromu tedavisi için yapılan ameliyatla (laparoskopik ovarian drilling) göbek deliğinin altından 0.5 cm lik bir açıklıktan kamera yardımı ile tespit edilen yumurtalıkların dış kısmına (korteks) elektrik akımı (elektrokoter) veya lazer ile 4 mm çapında ve 8 mm derinliğinde 5-10 adet küçük delik açılarak erkeklik hormonlarının üretimi ve etkinliği azaltılır(87,149,334).

∗Polikistik over sendromu tedavisinde uzun zamandan beri kullanılan çok sayıda bitki vardır. Bu bitkilerin bir kısmının etkili olduğu bilimsel çalışmalar ile gösterilmiştir.
∗Bu bitkiler kişide görülen belirtilere, muayene bulgularına, hormon düzeylerine ve hastalık geçmişine göre yardımcı tedavi amacıyla kullanılmaktadır. Herkese uygulanan standart bir tedavi reçetesi yoktur. Bilinçsizce ve rastgele kullanılmaları fayda sağlamak yerine tehlikeli olabilmektedir.
Polikistik over sendromu tedavisinde kullanılan bitkileri laboratuvar deneyleri, hayvan çalışmaları ve insanlarda yapılan klinik çalışmalar sonucunda etki mekanizmalarına göre 3 gruba ayırabiliriz;
A-grubu İnsülin direncine karşı duyarlılığı arttırarak etki gösteren bitkiler (Tablo-1); Polikistik over sendromu’nda fazla kilolu ve şişman olan veya normal kilolu fakat bel çevresi kalın (erkek tipi yağlanma) olan kadınların büyük çoğunluğunda insülin direnci görülmektedir(61,62,63,64). İnsülin direncinin ilerlemesi, kötüye gitmesi sonucunda bozulmuş glukoz (şeker) toleransı ve şeker hastalığı (Diabetes mellitus) gelişmektedir. (65,66,67,68,69,70,71). Polikistik over sendromu olan kadınlarda genellikle insülin direnci daha hızlı bir şekilde ilerlediği, kötüye gittiği için bozulmuş şeker toleransı ve şeker hastalığı ergenlik (adolesan) döneminden itibaren daha genç yaşlarda ortaya çıkmaktadır(68,69,72).
Tablo-1
İnsülin direncine karşı duyarlılığı arttırarak etki gösteren bitkiler;
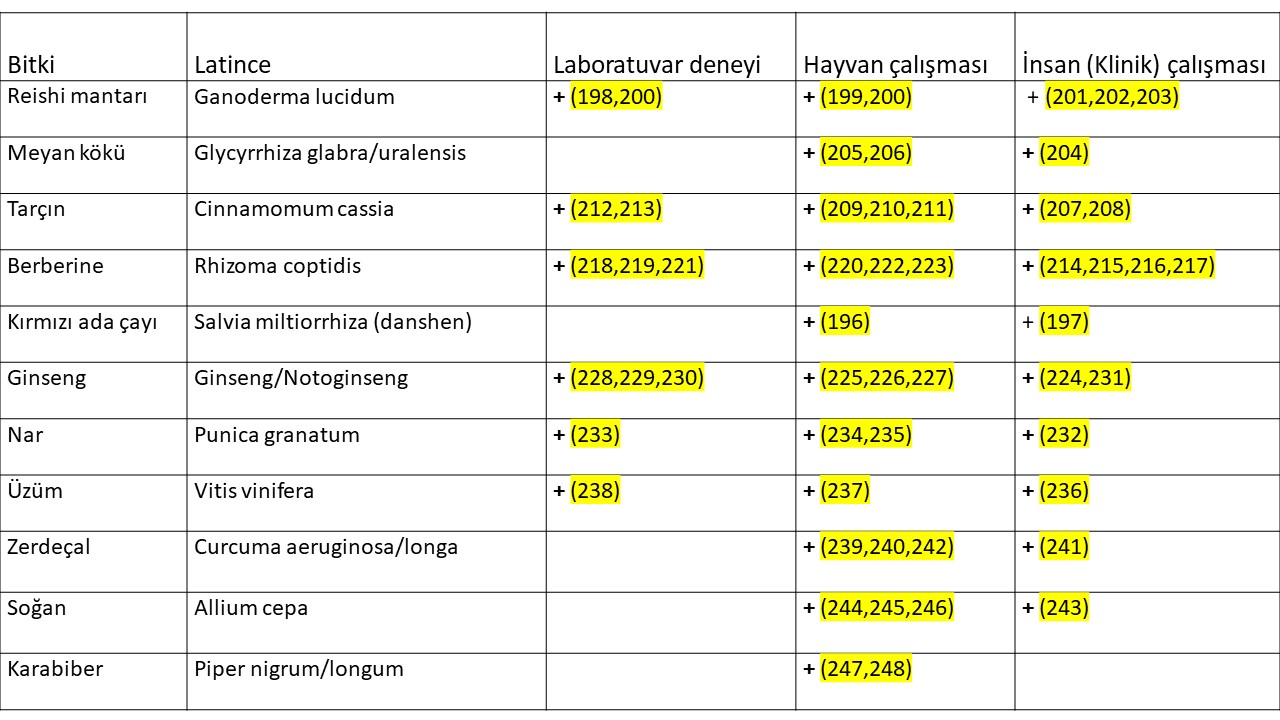

A1– İnsülin direnci nedeniyle kan dolaşımında fazla miktarda bulunan insülin hormonu polikistik over sendromu olan kadınların bir kısmında hem doğrudan yumurtalığa giderek hem de hipofiz bezinde LH (luteinizing hormon) üretimini arttırarak olgun folikül (preovulatory) (dominant) oluşumunu ve takiben yumurtlamayı (ovulation) engellemektedir(73,74). Bunun sonucunda adet kanamaları 35 gün ile 3 ay arasında değişen aralıklarla (oligomenorrhea) veya 3 aydan daha uzun aralıklarla (amenorrhea) olanlarda adet kanamaları 21 ila 35 günde bir (eumenorrhea) olanlara göre insülin direnci ve şeker hastalığı (diabetes mellitus ) daha sık görülmektedir(75,76,77,78,79).
A2- Kan dolaşımında fazla miktarda bulunan İnsülin hormonu doğrudan yumurtalığa giderek yumurtalıkta erkeklik hormonlarının üretimini arttırmaktadır (80,81,82,83,84,85). Erkeklik hormonlarının üretiminin artması (hiperandrogenism) nedeniyle bu kadınlarda tüylenme artışı, sivilce ve saç dökülmesi görülmektedir.
A3- Kan dolaşımında fazla miktarda bulunan insülin hormonu beyinde yer alan hipofiz bezinde erkeklik hormonlarının yumurtalıkta yapılmasını sağlayan LH (luteinizing hormon) üretimini arttırmaktadır(86,87,88,89). LH (luteinizing hormon) miktarının artması erkeklik hormonlarının yapımını arttırmaktadır (hiperandrogenism)(85,87,89,90).
A4- Karaciğerde üretilen sex hormone binding globulin (SHBG) erkeklik hormonlarına bağlanarak kan dolaşımında serbest bulunan etkin formların (serbest testosteron) miktarını azaltmaktadır(91,92). Kan dolaşımında fazla miktarda bulunan insülin hormonu sex hormone binding globulin (SHBG) üretimini azaltmaktadır(93).

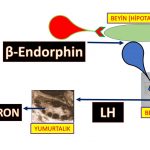
B-grubu GnRH hormonu salgılayan jeneratörü (dinamo) etkileyerek LH (luteinizing hormon) miktarını azaltan bitkiler (Tablo-2); Beyinde hipotalamus bölgesinde GnRH (Gonadotropin-releasing hormone) salgılayan sinir hücreleri (neurons) bulunmaktadır(94,95). GnRH hormonunun belirli aralıklarla artışlar ve azalışlar gösterek salgılanmasına bağlı olarak hipofiz bezinde LH ve FSH hormonların üretim sıklığı ve miktarı belirlenmektedir(96,97,98).
Polikistik over sendromu olan kadınların bir kısmında erkeklik hormonlarının (testosteron, dihidrotestosteron) fazla miktarda üretilmesi ve insülin direncine bağlı insülin miktarının artması beyinde GnRH (Gonadotropin-releasing hormone) salgılayan hücrelerden daha üst seviyelerde bulunan sinir hücrelerinde üretilen GABA ve Kisspeptin (neurotransmitters) salgılanmasını etkileyerek GnRH hormonu salgılayan jeneratörün (dinamo) fazla çalışmasına neden olmaktadır. (96,99,100,101,102). GnRH hormonunun salgılanma sıklığının artması hipofiz bezinde üretilen LH hormonunun salgılanma sıklığının (frequency) ve kan dolaşımında bulunan miktarının artmasına neden olmaktadır. (96,98,103,104,105,106,107,108,109). LH (luteinizing hormon) miktarının artması erkeklik hormonlarının yumurtalıkta yapımını arttırmakta (hiperandrogenism) ve yumurtlama öncesi olgun folikül (dominant) gelişimini ve yumurtlamayı (ovulasyon) engellemektedir. (98,109,110,111,112,113,114,115,116,117,118).
Tablo-2
GnRH hormonu salgılayan jeneratörü (dinamo) etkileyerek LH (luteinizing hormon) miktarını azaltan bitkiler;


C-grubu Erkeklik hormonu (testosteron, dihidrotestosteron) üretimini azaltarak etki gösteren bitkiler (Tablo-3); Kadınlarda erkeklik hormonlarının (testosteron, dihidrotestosteron) büyük bir kısmı böbrek üstü bezinde üretilen DHEA (Dehydroepiandrosterone) ve Androstenedione hormonlarından deri, meme, ve yağ dokusunda üretilmektedir(119,120). Erkeklik hormonlarının küçük bir kısmı ise yumurtalık ve böbrek üstü bezinde üretilmektedir(120,121). Kan dolaşımında bulunan testosteron yumurtalık ve böbrek üstü bezinde üretilen miktarı göstermektedir. Testosteron hormonunun büyük kısmının üretildiği deri, yağ dokusu, meme gibi organlardan sadece küçük bir miktar (%10) testosteron kan dolaşımına girmektedir(121).
Tablo-3
Erkeklik hormonu (testosteron, dihidrotestosteron) üretimini azaltarak etki gösteren bitkiler;
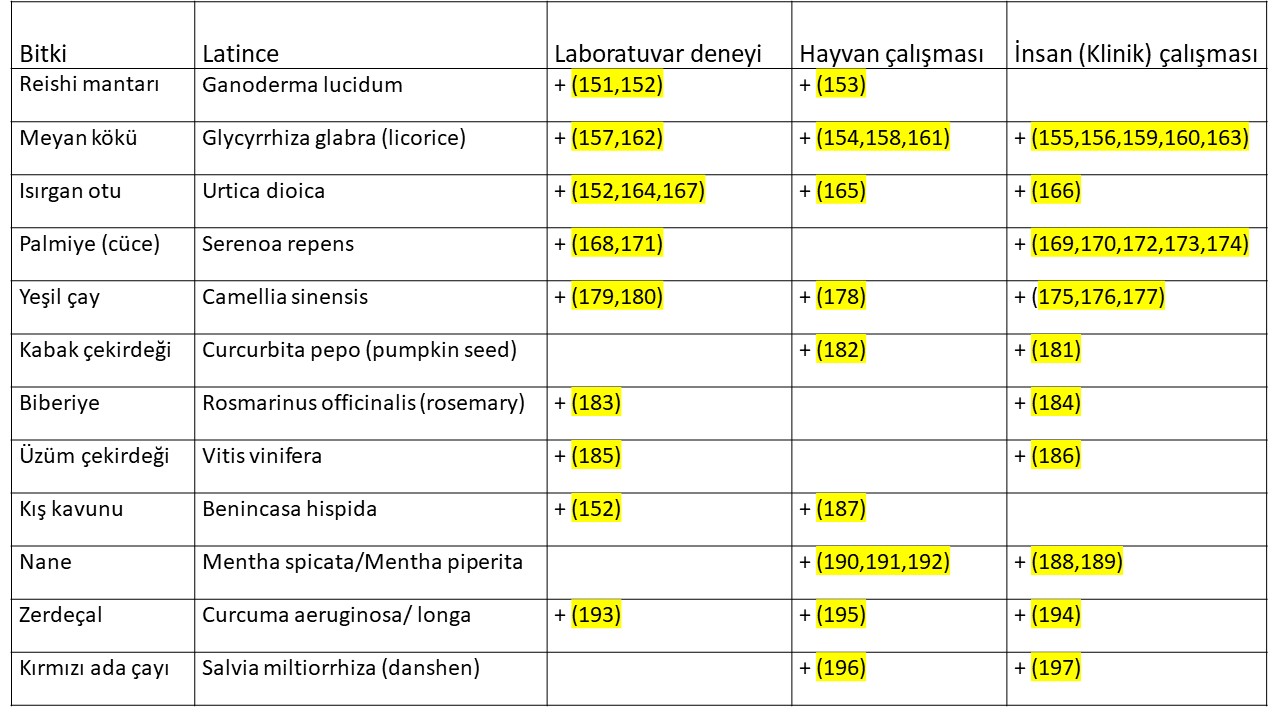
C1-Kan dolaşımında olmayan testosteron hormonunun büyük çoğunluğu 5- α reduktaz (reductase) enzimi tarafından üretildiği organda testosteron hormonundan 10 kat daha güçlü bir etkiye sahip olan dihidrotestosteron hormonuna dönüşmektedir(122,123,124,125). Dihidrotestosteron hormonunun etkili olabilmesi için erkeklik hormonu alıcısına (androgen receptor) tutunması gerekmektedir(126,127,128);
1-Erkeklik hormonu alıcıları deride en çok yağ bezlerinde (sebaceous glands), kıl köklerinde (dermal papilla) ve ter bezlerinde bulunmaktadır(129,130,131). Bu alıcılara tutunan dihidrotestosteron hormonu polikistik over sendromu olan kadınlarda tüylenme artışı, sivilce ve saç dökülmesine neden olmaktadır.

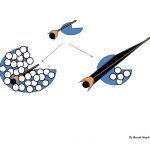
2-Erkeklik hormonları yumurtalıklarda alıcılara tutunarak folikül seçimi aşaması öncesinde bulunan ve daha küçük (< 2 mm) foliküllerin sayısını arttırırken folikül seçimi aşamasındaki (5-10 mm) foliküllerden bir tanesinin seçilerek daha ileri aşamaya ulaşmasını da engellemektedir (arrested follicles) (132,133,134,135,136,137,138,139). Yumurtlama öncesi olgunluğuna ulaşmış bir folikül oluşmadığı için polikistik over sendromu olan kadınlarda adet düzensizliği ortaya çıkmaktadır(111,112,113,141). Bu kadınlarda çoğunlukla 35 gün ile 3 ay arasında değişen aralıklarla (oligomenorrhea) adet kanamaları olmaktadır(141,142,144,145,146,147). Bir kısmında ise 3 aydan daha uzun aralıklarla (amenorrhea) adet kanamaları görülmektedir(141,143,144,145,146,147).
C2-Yumurtalıklarda erkeklik hormonları teka hücrelerinde üretilmektedir(87,148). İnsülin ve LH’ nın teka hücrelerinde erkeklik hormonlarının üretimini arttırmasının yanında polikistik over sendromu olan kadınların bir kısmında hem teka hücrelerinin sayısı fazla olduğu için hem de her bir teka hücresinde erkeklik hormonu üreten enzimin (CYP17 ) üretim kapasitesi yüksek olduğu için fazla miktarda erkeklik hormonu üretilmektedir(86,87,126,127,148,149,150).

Bitkiler, tedavi ve hastalıklardan korunma amacıyla çok uzun zamandan beri yaygın olarak kullanılmaktadır(1,2,3,8,11,12,13,20,21,22,23). Günümüzde kullanılan ilaçların büyük çoğunluğu bitkilerden elde edilen doğal maddelerin taklit edilmesiyle suni (sentetik) olarak üretilmektedir(4,5,6). Fakat, ilaçların bir kısmı hâlâ bitkilerden elde edilen maddelerden yapılmaya devam etmektedir(4,5,6). Bitkiler, ilaç tedavisinin yerine tek başına veya sentetik ya da bitki kaynaklı ilaçlarla birlikte destek amacıyla kullanılmaktadır(7,8,9,10,11,12,13). Bitkisel tedavi çoğunlukla deneysel çalışmalara bağlı bilimsel verilerin yerine daha çok kuşaktan kuşağa aktarılan gözleme dayalı bilgilere dayanmaktadır. Fakat buna karşılık, özellikle son 50 yıl içinde bitkilerin tedavi amacıyla kullanılması ile ilgili yapılan bilimsel çalışmaların sayısı giderek artmıştır(14,15).
BİTKİLERİN SAKINCALARI
1-Hormon bozukluklarında bitkiler miktarı azalmış olan hormonun arttırılması ya da miktarı artmış olan hormonun da azaltılması amacıyla kullanılmaktadır. Bitkilerin gereğinden fazla miktarlarda kullanılması azalmış olan hormonun gereğinden fazla artmasına veya artmış olan hormonun da gereğinden fazla azalmasına neden olmaktadır(10).
2-Bitkilerin gereğinden fazla miktarlarda kullanılmasına bağlı bitkinin içindeki etken maddelerin vücutta birikmesine bağlı karaciğer hasarı görülebilmektedir(24). Zayıflama amacıyla kullanılan bazı bitkisel tedaviler böbrek nakli (transplantasyon) ile sonuçlanan böbrek hasarına (interstitial renal fibrosis) neden olmaktadır(25,26,27,28). Bitkilerin bir kısmı kalp ve damar sistemi üzerine toksik etki göstermektedir. Bu bitkileri kullananlarda kan basıncı düşüklüğü (hipotansiyon), hipertansiyon, çarpıntı, kalp krizi ve kalp yetmezliği ortaya çıkabilmektedir(29,30,31,32,33).
∗Soğan (Allium cepa) bitkisinin belirli bir miktarın üzerinde kullanılması, içinde bulunan bazı maddeler (thiols, disulfides) nedeniyle soğan zehirlenmesine (toxicity) neden olmaktadır(266). Bu miktar kişiden kişiye göre değişmektedir. Kırmızı kan hücrelerinde (eritrositler) bulunan oksijeni taşıyan maddenin (hemoglobin) içindeki demir (Fe), soğan içinde bulunan maddeler (thiols, disulfides) tarafından oksitlenerek kan hücrelerinin parçalanmasına neden olmaktadır(267,268). Bunun sonucunda bu kişilerde ani başlayan, şiddetli kansızlık (hemolytic anemia) ortaya çıkmaktadır. Kırmızı kan hücrelerini Glucose-6-phosphate dehydrogenase (G6PD) enzimi zararlı maddelere karşı korumaktadır. Türkiye’ de bazı bölgelerde sık görülen G6PD enziminin doğuştan (genetik) eksikliği çoğunlukla hiçbir belirti göstermezken, soğan tüketimi bu kişilerde ani başlayan şiddetli kansızlığa neden olabilmektedir(269,270,271).
Bu tür masum gibi görünen bitkilerin bilinçsizce kullanılması fayda sağlamayacağı gibi hayati tehlikeye de neden olabilmektedir.
Bazı bitkilerin oluşturduğu allerjik reaksiyon akciğer hasarına (interstitial pneumonitis) neden olmaktadır(34,35). Bitkilerin bir kısmı kan pıhtılaşmasını (coagulation) azaltmaktadır(36,37). Bu bitkileri kullananlarda ameliyat sırasında kanama eğilimi ortaya çıkabilmektedir(36,37,38). Bitkilerin içinde bulunan maddelerin yan etkileri sonucunda bir çok kişi de hastanelerin acil servislerine zehirlenme (toxicity) nedeniyle başvurmak zorunda kalmaktadır(5,39,40,41,45).
3-Bitkisel tedavide bazen tek bir bitki veya bitkiden elde edilen (extraction) maddeler kullanılırken genellikle bu maddelerin karışımları kullanılmaktadır(2,7,8,10,11). Birden fazla bitkinin birlikte kullanılması bazen bitkilerin tek başına olan etkilerini arttırdığı (synergistic) gibi bazen de tek başına olan etkilerini (antagonistic) yok etmektedir(42,43,44). Bitkilerin birlikte kullanılması etkin maddenin kan dolaşımında bulunan miktarının artması sonucunda tek başına kullanıldıklarında görülmeyen beyin (neurotoxicity), karaciğer (hepatotoxicity) ve böbrek (nephrotoxicity) üzerinde toksik etkilerin ortaya çıkmasına neden olmaktadır(42,44).
4-İlaçlarla birlikte kullanılan bitkiler ilacın emilerek kan dolaşımına geçmesini (absorption), kan dolaşımında taşınmasını ve parçalandıktan (metabolism) sonra da böbreklerden atılmasını (clearance) etkilemektedir(46,47,48).
Bitkilerin ilaçlarla birlikte kullanılması ilaçların etkinliğini değiştirebildiği gibi yan etkilere ve toksik etkilere de neden olabilmektedir(46,49,50). Bazı bitkiler kanama zamanını uzattıkları için kan sulandırıcı ilaçlar ile birlikte kullanıldıklarında morarma ve kanama eğilimine neden olabilmektedir(48,49,50,51). Bazı bitkiler karaciğer hasarı yapma ihtimali olan ilaçlarla birlikte kullanıldıklarında karaciğer hasarına (hepatotoxicity) neden olabilmektedir(46,49). Bitkilerin bir kısmı kalp ilaçlarının etkinliğini arttırarak toksik etkilere neden olurken, bir kısmı da azaltarak bu ilaçların işlevini engellemektedir(52,60). Kan şekerini etkileyen bazı bitkiler diyabet tedavisinde kullanılan insülin ve ilaçların etkinliğini değiştirmektedir(53,54,55).
Yaşlanma (Aging) ile birlikte sürekliliği olan iltihap (kronik inflamasyon) artışı görülmektedir(7,56,57). Yaşlılığa neden olan kronik inflamasyon (inflamm-aging) oksidatif stres (oxidative stress) karşısında antioksidan (antioxidant) sistemin zayıflaması sonucunda ortaya çıkmaktadır(56,57). Yaşlanmaya neden olan kronik inflamasyonu azaltmak amacıyla kullanılan bazı bitkiler astım ve romatolojik hastalıkların tedavisinde kullanılan anti-inflamatuar ilaçların etkilerini arttırarak yan etkilere ve toksik etkilere neden olabilmektedir(58,59).
Kaynaklar
1-Ancient-modern concordance in Ayurvedic plants: some examples. Dev S. Environ Health Perspect. 1999 Oct;107(10):783-9.
2-Conpendium of materia medica (Bencau Gangmu). (cited 2016 April 15). Li S. https://www.wdl.org/en/item/4678/
3-Nature’s Medicine: Plants That Heal. Swerdlow JL. National Geographic Society. 2000.
4-The influence of natural products upon drug discovery. Newman DJ, Cragg GM, Snader KM. Nat Prod Rep. 2000 Jun;17(3):215-34.
5-Plants as source of drugs. Rates SM. Toxicon. 2001 May;39(5):603-13.
6-Plants and human health in the twenty-first century. Raskin I, Ribnicky DM, Komarnytsky S, Ilic N, Poulev A, Borisjuk N, Brinker A, Moreno DA, Ripoll C, Yakoby N, O’Neal JM, Cornwell T, Pastor I, Fridlender B. Trends Biotechnol. 2002 Dec;20(12):522-31.
7-Herbal Medicines: challenges in the modern world. Part 5. status and current directions of complementary and alternative herbal medicine worldwide. Enioutina EY, Salis ER, Job KM, Gubarev MI, Krepkova LV, Sherwin CM. Expert Rev Clin Pharmacol. 2017 Mar;10(3):327-338.
8-Herbal Medicines: challenges in the modern world. Part 3. China and Japan. Teng L, Zu Q, Li G, Yu T, Job KM, Yang X, Di L, Sherwin CM, Enioutina EY. Expert Rev Clin Pharmacol. 2016 Sep;9(9):1225-33.
9-World Health Organization. WHO traditional medicine strategy: 2014-2023; (cited 2016 Oct 20). http://apps.who.int/iris/bitstream/10665/92455/1/9789241506090_eng.pdf
10-ABC of complementary medicine: herbal medicine. Vickers A, Zollman C. BMJ. 1999 Oct 16;319(7216):1050-3.
11-Ibn Sina (Avicenna) Senior Press Superintendent, Jamia Hamdard Printing Press; New Delhi:1998. Kitāb al-Qānūn fī al-Tibb (Canon of medicine). https://www.herbcraft.org/canon2.pdf
12-Khare C.P. Springer: New York : 2007. Indian Medicinal Plants. https://archive.org/details/indianmedicinalplantsillustrateddictionarykharec.p._201_R
13-Royal College of Physicians of London. The London Pharmacopoeia. London: Edward Griffin; 1618. https://archive.org/details/2548018R.nlm.nih.gov/mode/2up
14-Quantification of the scientific research in the United States about popular herbal remedies referenced on PubMed. Hall M, Nazir N. Altern Ther Health Med. 2005 May-Jun;11(3):34-7.
15-Trends in publications on complementary and alternative medicine in the medical literature. Treister-Goltzman Y, Peleg R. J Complement Integr Med. 2015 Jun;12(2):111-5.
16-Diagnostic and treatment characteristics of polycystic ovary syndrome: descriptive measurements of patient perception and awareness from 657 confidential self-reports. Sills ES, Perloe M, Tucker MJ, Kaplan CR, Genton MG, Schattman GL BMC Womens Health. 2001;1(1):3.
17-Herbal medicine for the management of polycystic ovary syndrome (PCOS) and associated oligo/amenorrhoea and hyperandrogenism; a review of the laboratory evidence for effects with corroborative clinical findings. Arentz S, Abbott JA, Smith CA, Bensoussan A. BMC Complement Altern Med. 2014 Dec 18;14:511.
18-Phytotheraphy for polycystic ovarian syndrome: a review of the literature and evaluation of practitioners’ experiences. Rooney S, Pendry B. J Herbal Med. 2014 ;4:159-71.
19-A survey of the use of complementary medicine by a self-selected community group of Australian women with polycystic ovary syndrome. Arentz S, Smith CA, Abbott JA, Bensoussan A. BMC Complement Altern Med. 2014 Dec 6;14:472.
20-Unconventional medicine in the United States. Prevalence, costs, and patterns of use. Eisenberg DM, Kessler RC, Foster C, Norlock FE, Calkins DR, Delbanco TL. N Engl J Med. 1993 Jan 28;328(4):246-52.
21-Herbal medicines: challenges in the modern world. Part 1. Australia and New Zealand. Barnes J, McLachlan AJ, Sherwin CM, Enioutina EY. Expert Rev Clin Pharmacol. 2016 Jul;9(7):905-15.
22-Herbal medicines: challenges in the modern world. Part 2. European Union and Russia. Sammons HM, Gubarev MI, Krepkova LV, Bortnikova VV, Corrick F, Job KM, Sherwin CM, Enioutina EY. Expert Rev Clin Pharmacol. 2016 Aug;9(8):1117-27.
23-Herbal medicines: challenges in the modern world. Part 4. Canada and United States. Job KM, Kiang TK, Constance JE, Sherwin CM, Enioutina EY. Expert Rev Clin Pharmacol. 2016 Dec;9(12):1597-1609.
24-Systematic review of published data on herb induced liver injury. Byeon JH, Kil JH, Ahn YC, Son CG. J Ethnopharmacol. 2019 Apr 6;233:190-196.
25-Acute renal failure associated with prolonged intake of slimming pills containing anthraquinones. Kwan TH, Tong MK, Leung KT, Lai CK, Poon WT, Chan YW, Lo WH, Au TC. Hong Kong Med J. 2006 Oct;12(5):394-7.
26-Rapidly progressive interstitial renal fibrosis in young women: association with slimming regimen including Chinese herbs. Vanherweghem JL, Depierreux M, Tielemans C, Abramowicz D, Dratwa M, Jadoul M, Richard C, Vandervelde D, Verbeelen D, Vanhaelen-Fastre R. Lancet. 1993 Feb 13;341(8842):387-91.
27-Chinese herbs nephropathy presentation, natural history and fate after transplantation. Reginster F, Jadoul M, van Ypersele de Strihou C. Nephrol Dial Transplant. 1997 Jan;12(1):81-6.
28-Kidney toxicity related to herbs and dietary supplements: Online table of case reports. Part 3 of 5 series. Brown AC. Food Chem Toxicol. 2017 Sep;107(Pt A):502-519.
29-Heart Toxicity Related to Herbs and Dietary Supplements: Online Table of Case Reports. Part 4 of 5. Brown AC. J Diet Suppl. 2018 Jul 4;15(4):516-555.
30-Incidence and Causes of Aconitum Alkaloid Poisoning in Hong Kong from 1989 to 2010. Chan TY. Phytother Res. 2015 Aug;29(8):1107-11.
31-Aconite poisoning presenting as hypotension and bradycardia. Chan TY. Hum Exp Toxicol. 2009 Dec;28(12):795-7.
32-Acute effects of ephedra on autonomic nervous modulation in healthy young adults. Chen WL , Tsai TH, Yang CC, Kuo TB. Clin Pharmacol Ther. 2010 Jul;88(1):39-44.
33-Adverse cardiovascular and central nervous system events associated with dietary supplements containing ephedra alkaloids. Haller CA, Benowitz NL. N Engl J Med. 2000 Dec 21;343(25):1833-8.
34-Japanese herbal medicine-induced pneumonitis: A review of 73 patients.Enomoto Y, Nakamura Y, Enomoto N, Fujisawa T, Inui N, Suda T. Respir Investig. 2017 Mar;55(2):138-144.
35-Clinical features of pneumonitis induced by herbal drugs. Mizushima Y, Oosaki R, Kobayashi M. Phyto ther Res. 1997;11(4):295-298.
36-The influence of herbal medicine on platelet function and coagulation: a narrative review. McEwen BJ. Semin Thromb Hemost. 2015 Apr;41(3):300-14.
37-Commonly Used Dietary Supplements on Coagulation Function during Surgery. Wang CZ, Moss J, Yuan CS. Medicines (Basel). 2015 Sep;2(3):157-185.
38-Top-10 list of herbal and supplemental medicines used by cosmetic patients: what the plastic surgeon needs to know. Heller J, Gabbay JS, Ghadjar K, Jourabchi M, O’Hara C, Heller M, Bradley JP. Plast Reconstr Surg. 2006 Feb;117(2):436-45; discussion 446-7.
39-Emergency Department Visits for Adverse Events Related to Dietary Supplements. Geller AI, Shehab N, Weidle NJ, Lovegrove MC, Wolpert BJ, Timbo BB, Mozersky RP, Budnitz DS. N Engl J Med. 2015 Oct 15;373(16):1531-40.
40-Assessment of complementary and alternative medicine use among patients admitted to the emergency room: a descriptive study from a Turkish hospital. Hakkoymaz H, Koçyiğit BF. Peer J. 2019 Aug 20;7:e7584.
41-Use and toxicity of complementary and alternative medicines among patients visiting emergency department: Systematic review. Jatau AI, Aung MM, Kamauzaman TH, Chedi BA, Sha’aban A, Rahman AF. J Intercult Ethnopharmacol. 2016 Mar 2;5(2):191-7.
42-Analysis of Herb-Herb Interaction When Decocting Together by Using Ultra-High-Performance Liquid Chromatography-Tandem Mass Spectrometry and Fuzzy Chemical Identification Strategy With Poly-Proportion Design. Juan Shen , Xuan Mo, Yuping Tang, Li Zhang, Hanqing Pang, Yefei Qian, Yanyan Chen, Weiwei Tao, Sheng Guo, Erxin Shang, Shaoqing Zhu, Yunhe Ding, Jianming Guo, Pei Liu, Shulan Su, Dawei Qian, Jin-ao Duan. J Chromatogr. 2013 Jul 5;1297:168-178.
43-Revealing the Effects of the Herbal Pair of Euphorbia Kansui and Glycyrrhiza on Hepatocellular Carcinoma Ascites With Integrating Network Target Analysis and Experimental Validation. Yanqiong Zhang, Ya Lin, Haiyu Zhao, Qiuyan Guo, Chen Yan, Na Lin. Int J Biol Sci . 2016 Mar 25;12 (5), 594-606.
44-Analysis of Bioactive Components and Pharmacokinetic Study of Herb-Herb Interactions in the Traditional Chinese Patent Medicine Tongmai Yangxin Pill. Yaya Fan, Shuli Man, Hongfa Li , Yuanxue Liu, Zhen Liu, Wenyuan Gao. J Pharm Biomed Anal. 2016 Feb 2;120, 364-73.
45-African Burkitt’s lymphoma and an Epstein-Barr virus-enhancing plant Euphorbia tirucalli. Osato T, Mizuno F, Imai S, Aya T, Koizumi S, Kinoshita T, Tokuda H, Ito Y, Hirai N, Hirota M. Lancet. 1987 May 30;1(8544):1257-8.
46-A prospective study on the safety of herbal medicines, used alone or with conventional medicines. Jeong TY, Park BK, Cho JH, Kim YI, Ahn YC, Son CG. J Ethnopharmacol. 2012 Oct 11;143(3):884-8.
47-Underestimating the toxicological challenges associated with the use of herbal medicinal products in developing countries. Neergheen-Bhujun VS. Biomed Res Int. 2013;2013 :804086.
48-Clinical herbal interactions with conventional drugs: from molecules to maladies. Chen XW, Serag ES, Sneed KB, Liang J, Chew H, Pan SY, Zhou SF. Curr Med Chem. 2011;18(31):4836-50.
49-Herbal medicinals: selected clinical considerations focusing on known or potential drug-herb interactions. Miller LG. Arch Intern Med. 1998 Nov 9;158(20):2200-11.
50-Herb-drug interactions. Fugh-Berman A. Lancet. 2000 Jan 8;355(9198):134-8.
51-Potential interactions between complementary/alternative products and conventional medicines in a Medicare population. Elmer GW, Lafferty WE, Tyree PT, Lind BK. Ann Pharmacother. 2007 Oct;41(10):1617-24.
52-Traditional herbs: a remedy for cardiovascular disorders. Rastogi S, Pandey MM, Rawat AK. Phytomedicine. 2016 Oct 15;23(11):1082-9.
53-Review of Ginseng Anti-Diabetic Studies. Chen W, Balan P, Popovich DG. Molecules. 2019 Dec 9;24(24).
54-Chinese herbal medicines for people with impaired glucose tolerance or impaired fasting blood glucose. Grant SJ, Bensoussan A, Chang D, Kiat H, Klupp NL, Liu JP, Li X. Cochrane Database Syst Rev. 2009 Oct 7;(4):CD006690.
55-Ginsenoside Rb1 as an Anti-Diabetic Agent and Its Underlying Mechanism Analysis. Zhou P, Xie W, He S, Sun Y, Meng X, Sun G, Sun X. Cells. 2019 Feb 28;8(3).
56-Inflamm-aging. An evolutionary perspective on immunosenescence. Franceschi C, Bonafè M, Valensin S, Olivieri F, De Luca M, Ottaviani E, De Benedictis G. Ann N Y Acad Sci. 2000 Jun;908:244-54.
57-Inflammaging and Oxidative Stress in Human Diseases: From Molecular Mechanisms to Novel Treatments. Zuo L, Prather ER, Stetskiv M, Garrison DE, Meade JR, Peace TI, Zhou T. Int J Mol Sci. 2019 Sep 10;20(18).
58-An Update on Inflamm-Aging: Mechanisms, Prevention, and Treatment. Xia S, Zhang X, Zheng S, Khanabdali R, Kalionis B, Wu J, Wan W, Tai X. J Immunol Res.2016;2016:8426874.
59-Inflammaging and cardiovascular disease: Management by medicinal plants. Shayganni E, Bahmani M, Asgary S, Rafieian-Kopaei M. Phytomedicine. 2016 Oct 15;23(11):1119-26.
60-Cytochrome P450 isoforms involved in metabolism of the enantiomers of verapamil and norverapamil. Tracy TS, Korzekwa KR, Gonzalez FJ, Wainer IW. Br J Clin Pharmacol. 1999 May;47(5):545-52.
61-Profound peripheral insulin resistance, independent of obesity, in polycystic ovary syndrome. Dunaif A, Segal KR, Futterweit W, Dobrjansky A. Diabetes. 1989 Sep;38(9):1165-74.
62-Prediction models for insulin resistance in the polycystic ovary syndrome. Gennarelli G, Holte J, Berglund L, Berne C, Massobrio M, Lithell H. Hum Reprod. 2000 Oct;15(10):2098-102.
63-Use of fasting blood to assess the prevalence of insulin resistance in women with polycystic ovary syndrome. Carmina E , Lobo RA. Fertil Steril. 2004 Sep;82(3):661-5.
64-Prevalence of insulin resistance in the polycystic ovary syndrome using the homeostasis model assessment. DeUgarte CM, Bartolucci AA, Azziz R. Fertil Steril. 2005 May;83(5):1454-60.
65-Prevalence and predictors of risk for type 2 diabetes mellitus and impaired glucose tolerance in polycystic ovary syndrome: a prospective, controlled study in 254 affected women. Legro RS, Kunselman AR, Dodson WC, Dunaif A. J Clin Endocrinol Metab. 1999 Jan;84(1):165-9.
66-Prevalence of impaired glucose tolerance and diabetes in women with polycystic ovary syndrome. Ehrmann DA, Barnes RB, Rosenfield RL, Cavaghan MK, Imperial J. Diabetes Care. 1999 Jan;22(1):141-6.
67-Screening for abnormal glucose tolerance in adolescents with polycystic ovary syndrome. Palmert MR, Gordon CM, Kartashov AI, Legro RS, Emans SJ, Dunaif A. J Clin Endocrinol Metab. 2002 Mar;87(3):1017-23.
68-Polycystic ovarian syndrome (PCOS): a significant contributor to the overall burden of type 2 diabetes in women. Talbott EO, Zborowski JV, Rager JR, Kip KE, Xu X, Orchard TJ. J Womens Health (Larchmt). 2007 Mar;16(2):191-7.
69-Relative risk of conversion from normoglycaemia to impaired glucose tolerance or non-insulin dependent diabetes mellitus in polycystic ovarian syndrome. Norman RJ, Masters L, Milner CR, Wang JX, Davies MJ. Hum Reprod. 2001 Sep;16(9):1995-8.
70-Glucose intolerance in a large cohort of mediterranean women with polycystic ovary syndrome: phenotype and associated factors. Gambineri A, Pelusi C, Manicardi E, Vicennati V, Cacciari M, Morselli-Labate AM, Pagotto U, Pasquali R. Diabetes. 2004 Sep;53(9):2353-8.
71-Predictors of progression from impaired glucose tolerance to NIDDM: an analysis of six prospective studies. Edelstein SL, Knowler WC, Bain RP, Andres R, Barrett-Connor EL, Dowse GK, Haffner SM, Pettitt DJ, Sorkin JD, Muller DC, Collins VR, Hamman RF. Diabetes. 1997 Apr;46(4):701-10.
72-Changes in glucose tolerance over time in women with polycystic ovary syndrome: a controlled study. Legro RS, Gnatuk CL, Kunselman AR, Dunaif A. J Clin Endocrinol Metab. 2005 Jun;90(6):3236-42.
73-Follicle dynamics and anovulation in polycystic ovary syndrome. Franks S, Stark J, Hardy K. Hum Reprod Update. 2008 Jul-Aug;14(4):367-78.
74-Long-term follow-up of patients with polycystic ovary syndrome: reproductive outcome and ovarian reserve. Hudecova M, Holte J, Olovsson M, Sundström Poromaa I. Hum Reprod. 2009 May;24(5):1176-83.
75-The severity of menstrual dysfunction as a predictor of insulin resistance in PCOS. Brower M, Brennan K, Pall M, Azziz R. J Clin Endocrinol Metab. 2013 Dec;98(12):E1967-71.
76-The relationship of insulin insensitivity to menstrual pattern in women with hyperandrogenism and polycystic ovaries. Robinson S, Kiddy D, Gelding SV, Willis D, Niththyananthan R, Bush A, Johnston DG, Franks S. Clin Endocrinol (Oxf). 1993 Sep;39(3):351-5.
77-Characterization of groups of hyperandrogenic women with acanthosis nigricans, impaired glucose tolerance, and/or hyperinsulinemia. Dunaif A, Graf M, Mandeli J, Laumas V, Dobrjansky A. J Clin Endocrinol Metab. 1987 Sep;65(3):499-507.
78-Menstrual Cycle Irregularity and Metabolic Disorders: A Population-Based Prospective Study. Rostami Dovom M, Ramezani Tehrani F, Djalalinia S, Cheraghi L, Behboudi Gandavani S, Azizi F. PLoS One. 2016 Dec 16;11(12):e0168402.
79-Long or highly irregular menstrual cycles as a marker for risk of type 2 diabetes mellitus. Solomon CG, Hu FB, Dunaif A, Rich-Edwards J, Willett WC, Hunter DJ, Colditz GA, Speizer FE, Manson JE. JAMA. 2001 Nov 21;286(19):2421-6.
80-Insulin stimulates testosterone biosynthesis by human thecal cells from women with polycystic ovary syndrome by activating its own receptor and using inositolglycan mediators as the signal transduction system. Nestler JE, Jakubowicz DJ, de Vargas AF, Brik C, Quintero N, Medina F. J Clin Endocrinol Metab. 1998 Jun;83(6):2001-5.
81-Insulin stimulates androgen accumulation in incubations of human ovarian stroma and theca. Barbieri RL, Makris A, Ryan KJ. Obstet Gynecol. 1984 Sep;64(3 Suppl):73S-80S.
82-Insulin stimulates androgen accumulation in incubations of ovarian stroma obtained from women with hyperandrogenism. Barbieri RL, Makris A, Randall RW, Daniels G, Kistner RW, Ryan KJ. J Clin Endocrinol Metab. 1986 May;62(5):904-10.
83-Metabolic regulation of androgen production by human thecal cells in vitro. Nahum R, Thong KJ, Hillier SG. Hum Reprod. 1995 Jan;10(1):75-81.
84-Regulation of androgen production in cultured human thecal cells by insulin-like growth factor I and insulin. Bergh C , Carlsson B, Olsson JH, Selleskog U, Hillensjö T. Fertil Steril. 1993 Feb;59(2):323-31.
85-Differential effects of insulin sensitivity on androgens in obese women with polycystic ovary syndrome or normal ovulation. Asagami T, Holmes TH, Reaven G. Metabolism. 2008 Oct;57(10):1355-60.
86-Thecal cell sensitivity to luteinizing hormone and insulin in polycystic ovarian syndrome. Cadagan D, Khan R, Amer S. Reprod Biol. 2016 Mar;16(1):53-60.
87-Hypersecretion of androstenedione by isolated thecal cells from polycystic ovaries. Gilling-Smith C, Willis DS, Beard RW, Franks S. J Clin Endocrinol Metab. 1994 Oct;79(4):1158-65.
88-Insulin action in the normal and polycystic ovary. Franks S, Gilling-Smith C, Watson H, Willis D. Endocrinol Metab Clin North Am. 1999 Jun;28(2):361-78.
89-Hyperinsulinemia amplifies GnRH agonist stimulated ovarian steroid secretion in women with polycystic ovary syndrome. Tosi F, Negri C, Perrone F, Dorizzi R, Castello R, Bonora E, Moghetti P. J Clin Endocrinol Metab. 2012 May;97(5):1712-9.
90-Oestradiol feedback stimulation of androgen biosynthesis by human theca cells. Gilling-Smith C, Willis DS, Franks S. Hum Reprod. 1997 Aug;12(8):1621-8.
91-Secretion of testosterone-estradiol-binding globulin by a human hepatoma-derived cell line. Khan MS, Knowles BB, Aden DP, Rosner W. J Clin Endocrinol Metab. 1981 Aug;53(2):448-9.
92-Molecular properties of corticosteroid binding globulin and the sex-steroid binding proteins. Hammond GL. Endocr Rev. 1990 Feb;11(1):65-79.
93-Regulation of production and secretion of sex hormone-binding globulin in HepG2 cell cultures by hormones and growth factors. Loukovaara M, Carson M, Adlercreutz H. J Clin Endocrinol Metab. 1995 Jan;80(1):160-4.
94-Pituitary stalk portal blood collection in rhesus monkeys: evidence for pulsatile release of gonadotropin-releasing hormone (GnRH). Carmel PW, Araki S, Ferin M. Endocrinology. 1976 Jul;99(1):243-8.
95-Frequency and amplitude of gonadotropin-releasing hormone stimulation and gonadotropin secretion in the rhesus monkey. Wildt L, Häusler A, Marshall G, Hutchison JS, Plant TM, Belchetz PE, Knobil E. Endocrinology. 1981 Aug;109(2):376-85.
96-GnRH pulse frequency-dependent differential regulation of LH and FSH gene expression. Thompson IR, Kaiser UB. Mol Cell Endocrinol. 2014 Mar 25;385(1-2):28-35.
97-The frequency of gonadotropin-releasing-hormone stimulation differentially regulates gonadotropin subunit messenger ribonucleic acid expression. Dalkin AC, Haisenleder DJ, Ortolano GA, Ellis TR, Marshall JC. Endocrinology. 1989 Aug;125(2):917-24.
98-The origins and sequelae of abnormal neuroendocrine function in polycystic ovary syndrome. Blank SK, McCartney CR, Marshall JC. Hum Reprod Update. 2006 Jul-Aug;12(4):351-61.
99-Kisspeptins and reproduction: physiological roles and regulatory mechanisms. Pinilla L, Aguilar E, Dieguez C, Millar RP, Tena-Sempere M. Physiol Rev. 2012 Jul;92(3):1235-316.
100-Polycystic ovarian syndrome: evidence that flutamide restores sensitivity of the gonadotropin-releasing hormone pulse generator to inhibition by estradiol and progesterone. Eagleson CA, Gingrich MB, Pastor CL, Arora TK, Burt CM, Evans WS, Marshall JC. J Clin Endocrinol Metab. 2000 Nov;85(11):4047-52.
101-Ontogeny and reversal of brain circuit abnormalities in a preclinical model of PCOS. Silva MS, Prescott M, Campbell RE. JCI Insight. 2018 Apr 5;3(7).
102-The neuroendocrine genesis of polycystic ovary syndrome: A role for arcuate nucleus GABA neurons. Moore AM, Campbell RE. J Steroid Biochem Mol Biol. 2016 Jun;160:106-17.
103-Circulating luteinizing hormone pulse frequency in women with polycystic ovary syndrome. Kazer RR, Kessel B, Yen SS. J Clin Endocrinol Metab. 1987 Aug;65(2):233-6.
104-Opioidergic regulation of LH pulsatility in women with polycystic ovary syndrome. Berga SL, Yen SS. Clin Endocrinol (Oxf). 1989 Feb;30(2):177-84.
105-Inappropriate secretion of follicle-stimulating hormone and luteinizing hormone in polycystic ovarian disease. Yen SS, Vela P, Rankin J. J Clin Endocrinol Metab. 1970 Apr;30(4):435-42.
106-Determinants of abnormal gonadotropin secretion in clinically defined women with polycystic ovary syndrome. Taylor AE, McCourt B, Martin KA, Anderson EJ, Adams JM, Schoenfeld D, Hall JE. J Clin Endocrinol Metab. 1997 Jul;82(7):2248-56.
107-Hyperfunction of the hypothalamic-pituitary axis in women with polycystic ovarian disease: indirect evidence for partial gonadotroph desensitization. Waldstreicher J, Santoro NF, Hall JE, Filicori M, Crowley WF Jr. J Clin Endocrinol Metab. 1988 Jan;66(1):165-72.
108-Genome-wide association of polycystic ovary syndrome implicates alterations in gonadotropin secretion in European ancestry populations. Hayes MG, Urbanek M, Ehrmann DA, Armstrong LL, Lee JY, Sisk R, Karaderi T, Barber TM, McCarthy MI, Franks S,Lindgren CM, Welt CK, Diamanti-Kandarakis E, Panidis D, Goodarzi MO, Azziz R, Zhang Y, James RG, Olivier M,Kissebah AH; Reproductive Medicine Network, Stener-Victorin E, Legro RS, Dunaif A. Nat Commun. 2015 Aug 18;6:7502.
109-Metabolic regulation of androgen production by human thecal cells in vitro. Nahum R, Thong KJ, Hillier SG. Hum Reprod. 1995 Jan;10(1):75-81.
110-Estradiol production by granulosa cells of normal and polycystic ovaries: relationship to menstrual cycle history and concentrations of gonadotropins and sex steroids in follicular fluid. Mason HD, Willis DS, Beard RW, Winston RM, Margara R, Franks S. J Clin Endocrinol Metab. 1994 Nov;79(5):1355-60.
111-Premature response to luteinizing hormone of granulosa cells from anovulatory women with polycystic ovary syndrome: relevance to mechanism of anovulation. Willis DS, Watson H, Mason HD, Galea R, Brincat M, Franks S. J Clin Endocrinol Metab. 1998 Nov;83(11):3984-91.
112-Etiology of anovulation in polycystic ovary syndrome. Franks S, Mason H, White D, Willis D. Steroids. 1998 May-Jun;63(5-6):306-7.
113-Follicle dynamics and anovulation in polycystic ovary syndrome. Franks S, Stark J, Hardy K. Hum Reprod Update. 2008 Jul-Aug;14(4):367-78.
114-Increased protein expression of LHCG receptor and 17α-hydroxylase/17-20-lyase in human polycystic ovaries. Comim FV, Teerds K, Hardy K, Franks S. Hum Reprod. 2013 Nov;28(11):3086-92.
115-Developmental programming: rescuing disruptions in preovulatory follicle growth and steroidogenesis from prenatal testosterone disruption. Veiga-Lopez A, Moeller J, Abbott DH, Padmanabhan V. J Ovarian Res. 2016 Jun 29;9(1):39.
116-Current concepts of the roles of follicle stimulating hormone and luteinizing hormone in folliculogenesis. Hillier SG. Hum Reprod. 1994 Feb;9(2):188-91.
117-Cellular aspects of pre-ovulatory folliculogenesis in primate ovaries. Hillier SG, Harlow CR, Shaw HJ, Wickings EJ, Dixson AF, Hodges JK. Hum Reprod. 1988 May;3(4):507-11.
118-Intrafollicular paracrine function of ovarian androgen. Hillier SG. J Steroid Biochem. 1987;27(1-3):351-7.
119-Intracrinology. Labrie F. Mol Cell Endocrinol. 1991 Jul;78(3):C113-8.
120-Endocrine and intracrine sources of androgens in women: inhibition of breast cancer and other roles of androgens and their precursor dehydroepiandrosterone. Labrie F, Luu-The V, Labrie C, Bélanger A, Simard J, Lin SX, Pelletier G. Endocr Rev. 2003 Apr;24(2):152-82.
121-DHEA and its transformation into androgens and estrogens in peripheral target tissues: intracrinology. Labrie F, Luu-The V, Labrie C, Simard J. Front Neuroendocrinol. 2001 Jul;22(3):185-212.
122-Sexual hormones in human skin. Zouboulis CC, Chen WC, Thornton MJ, Qin K, Rosenfield R. Horm Metab Res. 2007 Feb;39(2):85-95.
123-Dihydrotestosterone is a peripheral paracrine hormone. Horton R. J Androl. 1992 Jan-Feb;13(1):23-7.
124-Tissue distribution and ontogeny of steroid 5 alpha-reductase isozyme expression. Thigpen AE, Silver RI, Guileyardo JM, Casey ML, McConnell JD, Russell DW. J Clin Invest. 1993 Aug;92(2):903-10.
125-Relative binding affinity of anabolic-androgenic steroids: comparison of the binding to the androgen receptors in skeletal muscle and in prostate, as well as to sex hormone-binding globulin. Saartok T, Dahlberg E, Gustafsson JA. Endocrinology. 1984 Jun;114(6):2100-6.
126-The biochemical basis for increased testosterone production in theca cells propagated from patients with polycystic ovary syndrome. Nelson VL, Qin KN, Rosenfield RL, Wood JR, Penning TM, Legro RS, Strauss JF 3rd, McAllister JM. J Clin Endocrinol Metab. 2001 Dec;86(12):5925-33.
127-Luteinizing hormone receptor, steroidogenesis acute regulatory protein, and steroidogenic enzyme messenger ribonucleic acids are overexpressed in thecal and granulosa cells from polycystic ovaries. Jakimiuk AJ, Weitsman SR, Navab A, Magoffin DA. J Clin Endocrinol Metab. 2001 Mar;86(3):1318-23.
128-Genetic and pharmacological evidence for more than one human steroid 5 alpha-reductase. Jenkins EP, Andersson S, Imperato-McGinley J, Wilson JD, Russell DW. J Clin Invest. 1992 Jan;89(1):293-300.
129-Localization of androgen receptors in human skin by immunohistochemistry: implications for the hormonal regulation of hair growth, sebaceous glands and sweat glands. Choudhry R, Hodgins MB, Van der Kwast TH, Brinkmann AO, Boersma WJ. J Endocrinol. 1992 Jun;133(3):467-75.
130-Location of androgen receptor in human skin. Bläuer M, Vaalasti A, Pauli SL, Ylikomi T, Joensuu T, Tuohimaa P. J Invest Dermatol. 1991 Aug;97(2):264-8.
131-Immunocytochemical localization of androgen receptors in human skin using monoclonal antibodies against the androgen receptor. Liang T, Hoyer S, Yu R, Soltani K, Lorincz AL, Hiipakka RA, Liao S. J Invest Dermatol. 1993 May;100(5):663-6.
132-5alpha-reductase 1 and 2 expression and activity in human ovarian follicles, stroma and corpus luteum as compared to neonatal foreskin. Haning RV, Jr, Tantravahi U, Zhao Q, Hackett RJ, Canick JA. J Steroid Biochem Mol Biol. 1996 Oct;59(2):199-204.
133-5alpha-reductase activity in women with polycystic ovary syndrome. Jakimiuk AJ, Weitsman SR, Magoffin DA. J Clin Endocrinol Metab. 1999 Jul;84(7):2414-8.
134-Stage-specific expression of androgen receptor, follicle-stimulating hormone receptor, and anti-Müllerian hormone type II receptor in single, isolated, human preantral follicles: relevance to polycystic ovaries. Rice S, Ojha K, Whitehead S, Mason H. J Clin Endocrinol Metab. 2007 Mar;92(3):1034-40.
135-In human granulosa cells from small antral follicles, androgen receptor mRNA and androgen levels in follicular fluid correlate with FSH receptor mRNA. Nielsen ME, Rasmussen IA, Kristensen SG, Christensen ST, Møllgård K, Wreford Andersen E, Byskov AG, Andersen C. Mol Hum Reprod. 2011 Jan;17(1):63-70.
136-Androgens regulate ovarian follicular development by increasing follicle stimulating hormone receptor and microRNA-125b expression. Sen A, Prizant H, Light A, Biswas A, Hayes E, Lee HJ, Barad D, Gleicher N, Hammes SR. Proc Natl Acad Sci U S A. 2014 Feb 25;111(8):3008-13.
137-Cloning of human androgen receptor complementary DNA and localization to the X chromosome. Lubahn DB, Joseph DR, Sullivan PM, Willard HF, French FS, Wilson EM. Science. 1988 Apr 15;240(4850):327-30.
138-The prevalence of polycystic ovaries in patients with congenital adrenal hyperplasia and their close relatives. Hague WM, Adams J, Rodda C, Brook CG, de Bruyn R, Grant DB, Jacobs HS. Clin Endocrinol (Oxf). 1990 Oct;33(4):501-10.
139-Polycystic ovaries in female-to-male transsexuals. Pache TD, Fauser BC. Clin Endocrinol (Oxf). 1993 Dec;39(6):702-3.
140-Nutrition, insulin and polycystic ovary syndrome. Franks S, Robinson S, Willis DS. Rev Reprod. 1996 Jan;1(1):47-53.
141-The severity of menstrual dysfunction as a predictor of insulin resistance in PCOS. Brower M, Brennan K, Pall M, Azziz R. J Clin Endocrinol Metab. 2013 Dec;98(12):E1967-71.
142-Women with polycystic ovary syndrome wedge resected in 1956 to 1965: a long-term follow-up focusing on natural history and circulating hormones. Dahlgren E, Johansson S, Lindstedt G, Knutsson F, Odén A, Janson PO, Mattson LA, Crona N, Lundberg PA. Fertil Steril. 1992 Mar;57(3):505-13.
143-Amenorrhea associated with bilateral polycystic ovaries. Stein IF, Leventhal ML. Am J Obstet Gynecol. 1935, 29(2):181-191.
144-Variation of the human menstrual cycle through reproductive life. Treloar AE, Boynton RE, Behn BG, Brown BW. Int J Fertil. 1967 Jan-Mar;12(1 Pt 2):77-126.
145-Polycystic ovary syndrome: the spectrum of the disorder in 1741 patients. Balen AH, Conway GS, Kaltsas G, TechatrasakK, Manning PJ, West C, Jacobs HS. Hum Reprod. 1995 Aug;10(8):2107-11.
146-Heterogeneity of the polycystic ovary syndrome: clinical, endocrine and ultrasound features in 556 patients. Conway GS, Honour JW, Jacobs HS. Clin Endocrinol (Oxf). 1989 Apr;30(4):459-70.
147-Androgen excess in women: experience with over 1000 consecutive patients. Azziz R, Sanchez LA, Knochenhauer ES, Moran C, Lazenby J, Stephens KC, Taylor K, Boots LR. J Clin Endocrinol Metab. 2004 Feb;89(2):453-62.
148-The ovarian androgen producing cells: a review of structure/function relationships. Erickson GF, Magoffin DA, Dyer CA, Hofeditz C. Endocr Rev. 1985 Summer;6(3):371-99.
149-Evidence for a primary abnormality of thecal cell steroidogenesis in the polycystic ovary syndrome. Gilling-Smith C, Story H, Rogers V, Franks S. Clin Endocrinol (Oxf). 1997 Jul;47(1):93-9.
150-Ovarian enzyme activities in women with polycystic ovary syndrome. Magoffin DA. Fertil Steril. 2006 ul;86 Suppl 1:S9-S11.
151-Anti-androgenic activities of Ganoderma lucidum. Fujita R, Liu J, Shimizu K, Konishi F, Noda K, Kumamoto S, Ueda C, Tajiri H, Kaneko S, Suimi Y, Kondo R. J Ethnopharmacol. 2005 Oct 31;102(1):107-12.
152-Evaluation of 5α-reductase inhibitory activity of certain herbs useful as antiandrogens. Nahata A, Dixit VK. Andrologia. 2014 Aug;46(6):592-601.
153-Ganoderma lucidum is an inhibitor of testosterone-induced prostatic hyperplasia in rats. Nahata A, Dixit VK. Andrologia. 2012 May;44 Suppl 1:160-74.
154-Effect of traditional herbal medicine, shakuyaku-kanzo-to on total and free serum testosterone levels. Takeuchi T, Nishii O, Okamura T, Yaginuma T. Am J Chin Med. 1989;17(1-2):35-44.
155-Licorice reduces serum testosterone in healthy women. Armanini D, Mattarello MJ, Fiore C, Bonanni G, Scaroni C, Sartorato P, Palermo M. Steroids.2004 Oct-Nov;69(11-12):763-6.
156-Treatment of polycystic ovary syndrome with spironolactone plus licorice. Armanini D, Castello R, Scaroni C, Bonanni G, Faccini G, Pellati D, Bertoldo A, Fiore C, Moghetti P. Eur J Obstet Gynecol Reprod Biol.2007 Mar;131(1):61-67.
157-Estrogen-like activity of glabrene and other constituents isolated from licorice root. Tamir S, Eizenberg M, Somjen D, Izrael S, Vaya J. J Steroid Biochem Mol Biol. 2001 Sep;78(3):291-8.
158-Estrogen-like activity of glabrene and other constituents isolated from licorice root. Tamir S, Eizenberg M, Somjen D, Izrael S, Vaya J. J Steroid Biochem Mol Biol. 2001 Sep;78(3):291-8.
159-Effect of TJ-68 (shakuyaku-kanzo-to) on polycystic ovarian disease. Takahashi K, Kitao M. Int J Fertil Menopausal Stud. 1994 Mar-Apr;39(2):69-76.
160-Alopecia: herbal remedies. Kaushik R, Gupta D, Yadav R. Int J Pharm Sci Res. 2011;2:1631-1637.
161-Hair growth stimulating effect and phytochemical evaluation of hydro-alcoholic extract of glycyrrhiza glabra. Saumendu DR, Raj KP. Glob J Res Med plants Indig Med. 2014;3:40-47.
162-Potentially of petroleum ether (60-80)ºC extract of Glycyrrhiza glabra on androgenic alopecia. Upadhyay S, Singh V. Asian J Pharm Clin Res. 2013;6:52-55.
163-Glycyrrhiza glabra: a phytopharmacological review. Int J Pharm Sci Res. 2013;4:2470-2477.
164-The effect of extracts of the roots of the stinging nettle (Urtica dioica) on the interaction of SHBG with its receptor on human prostatic membranes. Hryb DJ, Khan MS, Romas NA, Rosner W. Planta Med. 1995 Feb;61(1):31-2.
165-Ameliorative effects of stinging nettle (Urtica dioica) on testosterone-induced prostatic hyperplasia in rats. Nahata A, Dixit VK. Andrologia. 2012 May;44 Suppl 1:396-409.
166-Therapeutic effects of stinging nettle (Urtica dioica) in women with hyperandrogenism. Najafipour F, Rahimi AO, Mobaseri M, Aliasgharzadeh A. Int J Current Res Acad Rev. 2014;2(7):153-160.
167-Lignans from the roots of Urtica dioica and their metabolites bind to human sex hormone binding globulin (SHBG). Schöttner M, Gansser D, Spiteller G. Planta Med. 1997 Dec;63(6):529-32.
168-The effect of Permixon on androgen receptors. el-Sheikh MM, Dakkak MR, Saddique A. Acta Obstet Gynecol Scand. 1988;67(5):397-9.
169-Comparitive effectiveness of finasteride vs serenoa repens in male androgenetic alopecia: a two-year study. Rossi A, Mari E, Scarno M, Garelli V, Maxia C, Scali E, Iorio A, Carlesimo M. Int J Immunopathol Pharmacol. 2012 Oct-Dec;25(4):1167-73.
170- Serenoa Repens: Does it have Any Role in the Managenent of Androgenetic Alopecia? Murugusundram S. J Cutan Aesthet Surg. 2009 Jan;2(1):31-2.
171-Determination of the potency of a novel saw palmetto supercritical CO2 extract (SPSE) for 5α-reductase isoform II inhibition using a cell-free in vitro test system. Pais P, Villar A, Rull S. Res Rep Urol. 2016 Apr 21;8:41-9.
172-A randomized, double-blind, placebo-controlled trial to determine the effectiveness of botanically derived inhibitors of 5-alpha-reductase in the treatment of androgenetic alopecia. Prager N, Bickett K, French N, Marcovici G. J Altern Complement Med. 2002 Apr;8(2):143-52.
173-Tissue effects of saw palmetto and finasteride: use of biopsy cores for in situ quantification of prostatic androgens. Marks LS, Hess DL, Dorey FJ, Luz Macairan M, Cruz Santos PB, Tyler VE. Urology. 2001 May;57(5):999-1005.
174-Herbal preperations for the treatment of hair loss. Zgonc Škulj A, Poljšak N, Kočevar Glavač N, Kreft S. Arch Dermatol Res. 2019 Nov 3.
175-Effect of green tea on metabolic and hormonal aspect of polycystic ovarian syndrome in overweight and obese women suffering from polycystic ovarian syndrome: A clinical trial. Tehrani HG, Allahdadian M, Zarre F, Ranjbar H, Allahdadian F. J Educ Health Promot. 2017 May 5;6:36.
176-Effects of Chinese green tea on weight, and hormonal and biochemical profiles in obese patients with polycystic ovary syndrome–a randomized placebo-controlled trial. Chan CC, Koo MW, Ng EH, Tang OS, Yeung WS, Ho PC. J Soc Gynecol Investig. 2006 Jan;13(1):63-8.
177-Green Tea: A magical herb with miraculous outcomes. Jigisha A, Nishant R, Navin K, Pankaj G. IRJP. 2012;3(5):139-148.
178-The effects of tea polyphenolic compounds on hair loss among rodents. Esfandiari A, Kelly AP. J Natl Med Assoc.2005 Aug;97(8):1165-9.
179-Structure-activity relationships for inhibition of human 5alpha-reductases by polyphenols. Hiipakka RA, Zhang HZ, Dai W, Dai Q, Liao S. Biochem Pharmacol. 2002 Mar 15;63(6):1165-76.
180-Human hair growth enhancement in vitro by green tea epigallocatechin-3-gallate (EGCG). Kwon OS, Han JH, Yoo HG, Chung JH, Cho KH, Eun HC, Kim KH. Phytomedicine. 2007 Aug;14(7-8):551-5.
181-Effect of pumpkin seed oil on hair growth in men with androgenetic alopecia: a randomized, double-blind, placebo-controlled trial. Cho YH, Lee SY, Jeong DW, Choi EJ, Kim YJ, Lee JG, Yi YH, Cha HS. Evid Based Complement Alternat Med. 2014;2014:549721.
182-Inhibition of testosterone-induced hyperplasia of the prostate of sprague-dawley rats by pumpkin seed oil. Gossell-Williams M, Davis a, O’Connor N. J Med Food. 2006 Summer;9(2):284-6.
183-Promotion of hair growth by Rosmarinus officinalis leaf extract. Murata K, Noguchi K, Kondo M, Onishi M, Watanabe N, Okamura K, Matsuda H. Phytother Res. 2013 Feb;27(2):212-7.
184-Rosemary oil vs minoxidil 2% for the treatment of androgenetic alopecia: a randomized comparative trial. Panahi Y, Taghizadeh M, Marzony ET, Sahebkar A. Skinmed. 2015 Jan-Feb;13(1):15-21.
185-Proanthocyanidins from grape seeds promote proliferation of mouse hair follicle cells in vitro and convert hair cycle in vivo. Takahashi T, Kamiya T, Yokoo Y. Acta Derm Venereol. 1998 Nov;78(6):428-32.
186-Grape Seed Oil Compounds: Biological and Chemical Actions for Health. Garavaglia J, Markoski MM, Oliveira A, Marcadenti A. Nutr Metab Insights. 2016Aug 16;9:59-64.
187-Effect of Benincasa hispida fruits on testosterone-induced prostatic hypertrophy in albino rats. Nandecha C, Nahata A, Dixit VK. Curr Ther Res Clin Exp. 2010 Oct;71(5):331-43.
188-Effect of spearmint (Mentha spicata Labiatae) teas on androgen levels in women with hirsutism. Akdoğan M, Tamer MN, Cüre E, Cüre MC, Köroğlu BK, Delibaş N. Phytother Res.2007 May;21(5):444-7.
189-Spearmint herbal tea has significant anti-androgen effects in polycystic ovarian syndrome. A randomized controlled trial. Grant P. Phytother Res. 2010 Feb;24(2):186-8.
190-Effects of peppermint teas on plasma testosterone, follicle-stimulating hormone, and luteinizing hormone levels and testicular tissue in rats. Akdoğan M, Ozguner M, Kocak A, Oncu M, Cicek E. Urology.2004 Aug;64(2):394-8.
191-Role of Essential Oil of Mentha Spicata (Spearmint) in Addressing Reverse Hormonal and Folliculogenesis Disturbances in a Polycystic Ovarian Syndrome in a Rat Model. Sadeghi Ataabadi M, Alaee S, Bagheri MJ, Bahmanpoor S. Adv Pharm Bull. 2017 Dec;7(4):651-654.
192-A combination of spearmint and flaxseed extract improved endocrine and histomorphology of ovary in experimental PCOS. Mehraban M, Jelodar G, Rahmanifar F. J Ovarian Res. 2020 Mar 20;13(1):32.
193-Antitumor agents. 217. Curcumin analogues as novel androgen receptor antagonists with potential as anti-prostate cancer agents. Ohtsu H, Xiao Z, Ishida J, Nagai M, Wang HK, Itokawa H, Su CY, Shih C, Chiang T, Chang E, Lee Y, Tsai MY, Chang C, Lee KH. J Med Chem. 2002 Nov 7;45(23):5037-42.
194-Sesquiterpene-Enriched Extract of Curcuma aeruginosa Roxb. Retards Axillary Hair Growth: A Randomised, Placebo-Controlled, Double-Blind Study. Srivilai J, Nontakhot K, Nutuan T, Waranuch N, Khorana N, Wisuthiprot W, Scholfield CN, Champachaisri K, Ingkaninan K. Skin Pharmacol Physiol. 2018;31(2):99-106.
195-Anti-androgenic effect of sesquiterpenes isolated from the rhizomes of Curcuma aeruginosa Roxb. Suphrom N, Pumthong G, Khorana N, Waranuch N, Limpeanchob N, Ingkaninan K. Fitoterapia. 2012 Jul;83(5):864-71.
196-Cryptotanshinone reverses reproductive and metabolic disturbances in prenatally androgenized rats via regulation of ovarian signaling mechanisms and androgen synthesis. Yang X, Zhang Y, Wu X, Bae CS, Hou L , Kuang H, Wang Y, Stener-Victorin E Am J Physiol Regul Integr Comp Physiol. 2011 Apr;300(4):R869-75.
197-Effects of tanshinone on hyperandrogenism and the quality of life in women with polycystic ovary syndrome: protocol of a double-blind, placebo-controlled, randomised trial. Shen W, Zhang Y, Li W, Cong J, Zhou Y, Ng EH, Wu X. BMJ Open. 2013 Oct 25;3(10): e003646.
198-ReishiMax, mushroom based dietary supplement, inhibits adipocyte differentiation, stimulates glucose uptake and activates AMPK. Thyagarajan-Sahu A, Lane B, Sliva D. BMC Complement Altern Med. 2011 Sep 19;11:74.
199-Antidiabetic activity of Ganoderma lucidum polysaccharides F31 down-regulated hepatic glucose regulatory enzymes in diabetic mice. Xiao C, Wu Q, Zhang J, Xie Y, Cai W, Tan J. J Ethnopharmacol. 2017 Jan 20;196:47-57.
200-A novel PTP1B inhibitor extracted from Ganoderma lucidum ameliorates insulin resistance by regulating IRS1-GLUT4 cascades in the insülin signaling pathway. Yang Z , Wu F , He Y , Zhang Q , Zhang Y , Zhou G , Yang H , Zhou P. Food Funct. 2018 Jan 24;9(1):397-406.
201-New Insights into Bioactive Compounds of Traditional Chinese Medicines for ınsulin Resistance Based on Signaling Pathways. He J, Wang H, Vijg J. Chem Biodivers. 2019 Sep;16(9):e1900176.
202-Therapeutic Mechanisms of Herbal Medicines Against Insulin Resistance: A Review. Li J, Bai L, Wei F, Zhao J, Wang D, Xiao Y, Yan W, Wei J. Front Pharmacol. 2019 Jun 14;10:661.
203-Molecular mechanisms of bioactive polysaccharides from Ganoderma (Lingzhi), a review. Lu J, He R, Sun P, Zhang F, Linhardt RJ, Zhang A. Int J Biol Macromol. 2020 May 1;150:765-774.
204-Changes of Insulin resistance and Adipokines Following Supplementation with Glycyrrhiza Glabra L. Extract in Combination with a Low-Calorie Diet in Overweight and Obese Subjects: a Randomized Double Blind Clinical Trial. Alizadeh M, Namazi N, Mirtaheri E, Sargheini N, Kheirouri S. Adv Pharm Bull. 2018 Mar;8(1):123-130.
205-Glycyrrhizin ameliorates insulin resistance, hyperglycemia, dyslipidemia and oxidative stress in fructose-induced metabolic syndrome-X in rat model. Sil R, Ray D, Chakraborti AS. Indian J Exp Biol. 2013 Feb;51(2):129-38.
206-Suppression by licorice flavonoids of abdominal fat accumulation and body weight gain in high-fat diet-induced obese C57BL/6J mice. Aoki F, Honda S, Kishida H, Kitano M, Arai N, Tanaka H, Yokota S, Nakagawa K, Asakura T, Nakai Y, Mae T. Biosci Biotechnol Biochem. 2007 Jan;71(1):206-14.
207-Insulin resistance improvement by cinnamon powder in polycystic ovary syndrome: A randomized double-blind placebo controlled clinical trial. Hajimonfarednejad M, Nimrouzi M, Heydari M, Zarshenas MM, Raee MJ, Jahromi BN. Phytother Res. 2018 Feb;32(2):276-283.
208-The effect of cinnamon extract on insulin resistance parameters in polycystic ovary syndrome: a pilot study. Wang JG, Anderson RA, Graham GM 3rd, Chu MC , Sauer MV, Guarnaccia MM, Lobo RA. Fertil Steril. 2007 Jul;88(1):240-3.
209-Metabolic changes and hormonal disturbances in polycysticovarian syndromr rats and the amelioration effects of metformin and/or cinnamon extraction. Heibashy M, Mazen G, Shahin M. J Am Sci. 2013, 9(12):54-62.
210- The effect of cinnamon on polycystic ovary syndromr in a Mouse model. Dou L, Zheng Y, Li L, Gui X, Chen Y, Yu M, Guo Y. Reprod Biol Endocrinol. 2018 Oct 19;16(1):99.
211-Cinnamon extract (traditional herb) potentiates in vivo insulin-regulated glucose utilization via enhancing insulin signaling in rats. Qin B, Nagasaki M, Ren M, Bajotto G, Oshida Y, Sato Y. Diabetes Res Clin Pract. 2003 Dec;62(3):139-48.
212-Isolation and characterization of polyphenol type-A polymers from cinnamon with insulin-like biological activity. Anderson RA, Broadhurst CL, Polansky MM, Schmidt WF, Khan A, Flanagan VP, Schoene NW, Graves DJ. J Agric Food Chem. 2004 Jan 14;52(1):65-70.
213-Insulin-like biological activity of culinary and medicinal plant aqueous extracts in vitro. Broadhurst CL, Polansky MM, Anderson RA. J Agric Food Chem. 2000 Mar;48(3):849-52.
214-Efficacy and safety of berberine in the treatment of type 2 diabetes with insulin resistance: Protocol for a systematic review. Wang Y, Yan A, Li S, Liu B, Li H, Yan Y. Medicine (Baltimore). 2019Aug;98(35):e16947.
215-The Effect of Berberine on Reproduction and Metabolism in Women with Polycystic Ovary Syndrome: A Systematic Review and Meta-Analysis of Randomized Control Trials. Xie L, Zhang D, Ma H, He H, Xia Q, Shen W, Chang H, Deng Y, Wu Q, Cong J, Wang CC, Wu X. Evid Based Complement Alternat Med. 2019 Dec 13;2019:7918631.
216-The Effect of Berberine on Polycystic Ovary Syndrome Patients with Insulin Resistance (PCOS-IR): A Meta-Analysis and Systematic Review. Li MF, Zhou XM, Li XL. Evid Based Complement Alternat Med. 2018 Nov 14;2018:2532935.
217-Polycystic ovary syndrome management: a review of the possible amazing role of berberine. Rondanelli M, Infantino V, Riva A, Petrangolini G, Faliva MA, Peroni G, Naso M, Nichetti M, Spadaccini D, Gasparri C, Perna S. Arch Gynecol Obstet. 2020 Jan;301(1):53-60.
218- Berberine reduces insulin resistance induced by dexamethasone in theca cells in vitro. Zhao L, Li W, Han F, Hou L, Baillargeon JP, Kuang H, Wang Y, Wu X. Fertil Steril. 2011 Jan;95(1):461-3.
219-Systems pharmacology to investigate the interaction of berberine and other drugs in treating polycystic ovary syndrome. Wang Y, Fu X, Xu J, Wang Q, kuang H. Sci Rep. 2016 Jun 16;6:28089.
220- Berberine-improved visceral white adipose tissue insulin resistance associated with altered sterol regulatory element-binding proteins, liver x receptors, and peroxisome proliferator-activated receptors transcriptional programs in diabetic hamsters. Li GS, Liu XH, Zhu H, Huang L, Liu YL, Ma CM, Qin C. Biol Pharm Bull. 2011;34(5):644-54.
221- Berberine inhibits inflammatory response and ameliorates insulin resistance in hepatocytes. Lou T, Zhang Z, Xi Z, Liu K, Li L, Liu B, Huang F. Inflammation. 2011 Dec;34(6):659-67.
222-Structural changes of gut microbiota during berberine -mediated prevention of obesity and insulin resistance in high-fat diet-fed rats. Zhang X, Zhao Y, Zhang M, Pang X, Xu J, Kang C, Li M, Zhang C, Zhang Z, Zhang Y, Li X, Ning G, Zhao L. PLoS One. 2012;7(8):e42529.
223- Berberine a natural plant product, activates AMP-activated protein kinase with beneficial metabolic effects in diabetic and insulin-resistant states. Lee YS, Kim WS, Kim KH, Yoon MJ, Cho HJ, Shen Y, Ye JM, Lee CH, Oh WK, Kim CT, Hohnen-Behrens C, Gosby A, Kraegen EW, James DE, Kim JB. Diabetes. 2006 Aug;55(8):2256-64.
224-Ethanol extraction preparation of American ginseng (Panax quinquefolius L) and Korean red ginseng (Panax ginseng C.A. Meyer): differential effects on postprandial insulinemia in healthy individuals.De Souza LR, Jenkins AL, Jovanovski E, Rahelić D, Vuksan V. J Ethnopharmacol. 2015 Jan 15;159:55-61.J.
225-Adaptive thermogenesis in adipocytes: is beige the new brown?Wu P, Cohen BM Spiegelman Genes Dev. 2013, 27:234-50.
226-Ginsenoside Rb1 promotes browning through regulation of PPARg in 3T3-L1 adipocytes. Q. Mu, X. Fang, X. Li, J. Zhao, G. Wang, C. Guo, W. Shang. Biochem. Biophys. Res. Commun. 2015, 466, 530–535.
227-Central infammation and leptin resistance are attenuated by ginsenoside Rb1 treatment inobese mice fed a high-fat diet. Wu, Y, Yu, Y, Szabo, A, Han, M, Huang, X.F. PLoSONE 2014,9,e92618.
228-Ginsenoside Rb1 increases insulin sensitivity by activating AMP-activated protein kinase in male rats. Shen, L, Haas, M, Wang, D.Q, May, A, Lo, C.C, Obici, S, Tso, P.; Woods, S.C, Liu, M.Physiol. Rep. 2015, 3, e12543.
229-Ginsenoside Re reduces insulin resistance through activation of PPAR-γ pathway and inhibition of TNF-α production. Gao Y, Yang MF, Su YP, Jiang HM, You XJ, Yang YJ, Zhang HL. J Ethnopharmacol. 2013 May 20;147(2):509-16.
230- Ginsenoside Rb1 as an Anti-Diabetic Agent and its Underlying Mechanism Analysis. Zhou P, Xie W, He S, Sun Y, Meng X, Sun G, Sun X. Cells. 2019 Feb 28;8(3).
231-Anti-diabetic potential of Panax notoginseng saponins (PNS): a review. Uzayisenga R, Ayeka PA, Wang Y. Phytother Res. 2014 Apr;28(4):510-6.
232-Effect of synbiotic pomegranate juice on glycemic, sex hormone profile and anthropometric indices in PCOS: A randomized, triple blind, controlled trial. Esmaeilinezhad Z, Babajafari S, Sohrabi Z, Eskandari M, Amooee S, Barati-Boldaji R. Nutr Metab Cardiovasc Dis. 2019 Feb;29(2):201-208.
233- Antidiabetic effect of Punica granatum flowers: effect on hyperlipidemia, pancreatic cells lipid peroxidation and antioxidant enzymes in experimental diabetes. P. Bagri, M. Ali, V. Aeri, M. Bhowmik, S. Sultana. Food Chem. Toxicol. 2008, 47, 50–54.
234-Experimental study of Punica granatum flower polyphenol’s effect on IL-6, TXB2’s and PPAR-γ mRNA’s expression in IR rats. Q. Dou, Y. Y. Wei, Y. Li, D. Yan, L. Adi, T. Yuan, Y. Kurexi, K. Parhat. Chin. Pharm. Bull. 2010, 26, 794– 797.
235-Comparison of potential preventive effects of pomegranate flower, peel and seed oil on insülin resistance and inflammation in high-fat and high-sucrose diet-induced obesity mice model. Harzallah A, Hammami M, Kępczyńska MA, Hislop DC, Arch JR, Cawthorne MA, Zaibi MS. Arch Physiol Biochem. 2016 ;122(2):75-87.
236-Does grape seed oil improve inflammation and insulin resistance in overweight or obese women? Irandoost P, Ebrahimi-Mameghani M, Pirouzpanah S. Int J Food Sci Nutr. 2013;64(6):706–710.
237-Supplementation with viti vinifera L. skin extract improves insülin resistanceand prevents hepa tic lipid accumulation and steatosis in high-fat diet-fed mice. Santos IB, de Bem GF, Cordeiro VSC, da Costa CA, de Carvalho LCRM, da Rocha APM, da Costa GF, Ognibene DT, de Moura RS, Resende AC. Nutr Res. 2017 Jul;43:69-81.
238-Grape Sed Oil Compounds: Biological and Chemical Actions for Health. Garavaglia J, Markoski MM, Oliveira A, Marcadenti A. Nutr Metab Insights. 2016 Aug 16;9:59-64.
239-Curcumin prevents high fat diet induced insulin resistance and obesity via attenuating lipogenesis in liver and inflammatory pathway in adipocytes.W. Shao, Z. Yu, Y. Chiang, Y. Yang, T. Chai, W. Foltz, H. Lu, I. G. Fantus, T. Jin. PLoS One 2012, 7, e28784.
240-Curcumin improves insulin resistance in skeletal muscle of rats. L. X. Na, Y. L. Zhang, Y. Li, L. Y. Liu, R. Li, T. Kong, C. H. Sun. Nutr. Metab. Cardiovasc. Dis. 2011, 21, 526–533.
241-Curcumin extract for prevention of type 2 diabetes. Chuengsamarn S, Rattanamongkolgul S, Luechapudiporn R, Phisalaphong C, Jirawatnotai S. Diabetes Care. 2012 Nov;35(11):2121-7.
242-Targeting curcusomes to inflammatory dendritic cells inhibits NF-κB and improves insulin resistance in obese mice. Yekollu SK, Thomas R, O’Sullivan B. Diabetes. 2011 Nov;60(11):2928-38.
243-Effects of raw red onion consumption on metabolic features in overweight or obese women with polycystic ovary syndrome: a randomized controlled clinical trial. Ebrahimi-Mamaghani M, Saghafi-Asl M, Pirouzpanah S, Asghari-Jafarabadi M. J Obstet Gynaecol Res. 2014 Apr;40(4):1067-76.
244-In vivo effects of dietary quercetin and quercetin-rich red nion extract on skeletal muscle mitochondria, metabolism, and insülin sensitivity. Henagan TM, Cefalu WT, Ribnicky DM, Noland RC, Dunville K, Campbell WW, Stewart LK, Forney LA, Gettys TW, Chang JS, Morrison CD. Genes Nutr. 2015 Jan;10(1):451.
245-Testosterone in Males as Enhanced by Onion (Allium Cepa L.). Banihani SA. Biomolecules. 2019 Feb 21;9(2).
246- Onion peel extracts ameliorate hyperglycemia and insulin resistance in high fat diet/streptozotocin-induced diabetic rats. Jung JY, Lim Y, Moon MS, Kim JY, Kwon O. Nutr Metab. 2011 Mar 28; 8(1):18.
247- Piperine and Its Role in Chronic Diseases.G. Derosa, P. Maffioli, A. Sahebkar. Adv. Exp. Med. Biol. 2016, 928, 173– 184.
248- Piperine regulates glucose metabolism disorder in HepG2 cells of insulin resistance models via targeting upstream target of AMPK signaling pathway. C. Wan, Y. Wei, X. Li, L. Zhang, R. Yang, Z. Bao. China J. Chin. Mater. Med. 2017, 42, 542–547.
249-Activation of the mu-opiate receptor by Vitex agnus-castus methanol extracts: implication for its use in PMS. Webster DE, Lu J, Chen SN, Farnsworth NR, Wang ZJ. J Ethnopharmacol. 2006 Jun 30;106(2):216-21.
250-Opioidergic mechanisms underlying the actions of Vitex agnus-castus L. Webster DE, He Y, Chen SN, Pauli GF, Farnsworth NR, Wang ZJ. Biochem Pharmacol. 2011 Jan 1;81(1):170-7.
251-In vitro prolactin but not LH and FSH release is inhibited by compounds in extracts of Agnus castus: direct evidence for a dopaminergic principle by the dopamine receptor assay. Jarry H, Leonhardt S, Gorkow C, Wuttke W. Exp Clin Endocrinol. 1994;102(6):448-54.
252-Pharmacological activities of Vitex agnus-castus extracts in vitro. Meier B, Berger D, Hoberg E, Sticher O, Schaffner W. Phytomedicine. 2000 Oct;7(5):373-81.
253-Agnus castus extracts inhibit prolactin secretion of rat pituitary cells. Sliutz G, Speiser P, Schultz AM, Spona J, Zeillinger R. Horm Metab Res. 1993 May;25(5):253-5.
254-Gynecological efficacy and chemical investigation of Vitex agnus-castus L. fruits growing in Egypt. Ibrahim NA, Shalaby AS, Farag RS, Elbaroty GS, Nofal SM, Hassan EM. Nat Prod Res. 2008 Apr 15;22(6):537-46.
255-Mastodynon(R) bei weiblicher Sterilität. Gerhard I , Patek A, Monga B, Blank A, Gorkow C. Forsch Komplementarmed. 1998;5(6):272-278.
256-The efficacy of the complex medication Phyto-Hypophyson L in female, hormone-related sterility. A randomized, placebo-controlled clinical double-blind study. Bergmann J, Luft B, Boehmann S, Runnebaum B, Gerhard I. Forsch Komplementarmed Klass Naturheilkd. 2000 Aug;7(4):190-9.
257-Fructus agni casti and bromocriptine for treatment of hyperprolactinemia and mastalgia. Kilicdag EB, Tarim E, Bagis T, Erkanli S, Aslan E, Ozsahin K, Kuscu E. Int J Gynaecol Obstet. 2004 Jun;85(3):292-3.
258-Comparing the Effects of Agnugol and Metformin on Oligomenorrhea in Patients with Polycystic Ovary Syndrome: A Randomized Clinical Trial. Shayan A, Masoumi SZ, Shobeiri F, Tohidi S, Khalili A. J Clin Diagn Res. 2016 Dec;10(12):QC13-QC16.
259-Effects of extracts from Cimicifuga racemosa on gonadotropin release in menopausal women and ovariectomized rats. Düker EM, Kopanski L, Jarry H, Wuttke W. Planta Med. 1991. Oct;57(5):420-4.
260-Evidence for selective estrogen receptor modulator activity in a black cohosh (Cimicifuga racemosa) extract: comparison with estradiol-17beta. Seidlova-Wuttke D, Hesse O, Jarry H, Christoffel V, Spengler B, Becker T, Wuttke W. Eur J Endocrinol. 2003 Oct;149(4):351-62.
261-The effects of black cohosh on the regulation of estrogen receptor (ERα) and progesterone receptor (PR) in breast cancer cells. Szmyd M, Lloyd V, Hallman K, Aleck K, Mladenovik V, McKee C, Morse M, Bedgood T, Dinda S. Breast Cancer (Dove Med Press). 2018 Jan 18;10:1-11.
262-Antidiabetic effects of the Cimicifuga racemosa extract Ze 450 in vitro and in vivo in ob/ob mice. Moser C, Vickers SP, Brammer R, Cheetham SC, Drewe J. Phytomedicine. 2014 Sep 25;21(11):1382-9.
263-Studies on the endocrine effects of the contents of Cimicifuga racemosa. Jarry H, Harnischfeger G. Planta Med. 1985 Feb;51(1):46-9.
264-Adding the phytoestrogen Cimicifugae Racemosae to clomiphene induction cycles with timed intercourse in polycystic ovary syndrome improves cycle outcomes and pregnancy rates – a randomized trial. Shahin AY, Mohammed SA. Gynecol Endocrinol. 2014 Jul;30(7):505-10.
265-Role of phyto-oestrogens in ovulation induction in women with polycystic ovarian syndrome. Kamel HH. Eur J Obstet Gynecol Reprod Biol. 2013 May;168(1):60-3.
266-Economical and environmentally-friendly approaches for usage of onion (Allium cepa L.) waste. Sharma K, Mahato N, Nile SH, Lee ET, Lee YR. Food Funct. 2016 Aug 10;7(8):3354-69. 267-Toxicity of aromatic disulphides. I. Generation of superoxide radical and hydrogen peroxide by aromatic disulphides in vitro. Munday R. J Appl Toxicol. 1985Dec;5(6):402-8. 268-Toxicity of thiols and disulphides: involvement of free-radical species. Munday R. Free Radic Biol Med. 1989 ;7(6):659-73. 269-Toxic anemias and Heinz bodies. Fertman MH, Fertman MB. Medicine (Baltimore). 1955 May;34(2):131-92. 270-Erthrocyte glucose-6-phosphate dehydrogenase deficiency-a pharmacogenetic prototype. Keller DF. CRC Crit Rev Clin Lab Sci. 1970 May;1(2):247-302. 271- Glucose -6-phospate dehydrogenase deficiency in Çukurova Province, Turkey. Akoğlu T, Ozer FL, Ciğ S, Kŭmi M, Erdoğan A, Anil H. Int J Epidemiol. 1981 Mar;10(1):27-9.272-Classification of the types of androgenetic alopecia (common baldness) occurring in the female sex. Ludwig E. Br J Dermatol. 1977 Sep;97(3):247-54.
273-Androgens and the hair follicle. Cultured human dermal papilla cells as a model system. Randall VA, Thornton MJ, Hamada K, Redfern CP, Nutbrown M, Ebling FJ, Messenger AG. Ann N Y Acad Sci. 1991 Dec 26;642:355-75.
274-Balding hair follicle dermal papilla cells contain higher levels of androgen receptors than those from non-balding scalp. Hibberts NA, Howell AE, Randall VA. J Endocrinol. 1998 Jan;156(1):59-65.
275-Role of hormones in pilosebaceous unit development. Deplewski D, Rosenfield RL. Endocr Rev. 2000 Aug;21(4):363-92.
276-Hair follicle stem cell differentiation is inhibited through cross-talk between Wnt/β-catenin and androgen signalling in dermal papilla cells from patients with androgenetic alopecia. Leiros GJ, Attorresi AI, Balañá ME. Br J Dermatol.2012 May;166(5):1035-42.
277-The prevalence of hyperandrogenism in 109 consecutive female patients with diffuse alopecia. Futterweit W, Dunaif A, Yeh HC, Kingsley P. J Am Acad Dermatol. 1988 Nov;19(5 Pt 1):831-6.
278-Role of androgens in female-pattern androgenetic alopecia, either alone or associated with other symptoms of hyperandrogenism. Vexiau P, Chaspoux C, Boudou P, Fiet J, Abramovici Y, Rueda MJ, Hardy N, Reygagne P. Arch Dermatol Res. 2000 Dec;292(12):598-604.
279-Prevalence of polycystic ovaries in women with androgenic alopecia. Cela E, Robertson C, Rush K, Kousta E, White DM, Wilson H, Lyons G, Kingsley P, McCarthy MI, Franks S. Eur J Endocrinol. 2003 Nov;149(5):439-42.
280-Prevalence of androgenic alopecia in patients with polycystic ovary syndrome and characterization of associated clinical and biochemical features. Quinn M, Shinkai K, Pasch L, Kuzmich L, Cedars M, Huddleston H. Fertil Steril. 2014 Apr;101(4):1129-34.
281-Androgen action on human skin — from basic research to clinical significance. Zouboulis CC, Degitz K. Exp Dermatol. 2004;13 Suppl 4:5-10.
282-Hair density, hair diameter and the prevalence of female pattern hair loss. Birch MP, Messenger JF, Messenger AG. Br J Dermatol. 2001 Feb;144(2):297-304.
283-Clinical practice. Hair loss in women. Shapiro J. N Engl J Med. 2007 Oct 18;357(16):1620-30.
284-Understanding and management of female pattern alopecia. Leavitt M. Facial Plast Surg. 2008 Nov;24(4):414-27.
285-Dermatology of androgen-related disorders. Essah PA, Wickham EP 3rd, Nunley JR, Nestler JE. Clin Dermatol. 2006 Jul-Aug;24(4):289-98.
286-The midline part: an important physical clue to the clinical diagnosis of androgenetic alopecia in women. Olsen EA. J Am Acad Dermatol. 1999 Jan;40(1):106-9.
287-Androgenetic alopecia in women. Price VH. J Investig Dermatol Symp Proc. 2003 Jun;8(1):24-7.
288-Low sex-hormone binding globulin levels in young women with diffuse hair loss. Miller JA, Darley CR, Karkavitsas K, Kirby JD, Munro DD. Br J Dermatol. 1982 Mar;106(3):331-6.
289-Female androgenic alopecia. The 3 alpha,17 beta-androstanediol glucuronide/sex hormone binding globulin ratio as a possible marker for female pattern baldness. De Villez RL, Dunn J. Arch Dermatol. 1986 Sep;122(9):1011-5.
290-Cutaneous manifestations of the subtypes of polycystic ovary syndrome in Korean patients. Hong JS, Kwon HH, Park SY, Jung JY, Yoon JY, Min S, Choi YM, Suh DH. J Eur Acad Dermatol Venereol. 2015 Jan;29(1):42-7.
291-Hormone studies in females with androgenic hairloss. Schmidt JB, Lindmaier A, Trenz A, Schurz B, Spona J. Gynecol Obstet Invest. 1991;31(4):235-9.
292-Immunohistochemical distribution of aromatase and 3B-hydroxysteroid dehydrogenase in human hair follicle and sebaceous gland. Sawaya ME, Penneys NS. J Cutan Pathol. 1992 Aug;19(4):309-14. 293-Oxidative activity of the type 2 isozyme of 17beta-hydroxysteroid dehydrogenase (17beta-HSD) predominates in human sebaceous glands. Thiboutot D, Martin P, Volikos L, Gilliland K. J Invest Dermatol. 1998 Sep;111(3):390-5. 294-DHEA and its transformation into androgens and estrogens in peripheral target tissues: intracrinology. Labrie F, Luu-The V, Labrie C, Simard J. Front Neuroendocrinol. 2001 Jul;22(3):185-212.295-Control of human sebocyte proliferation in vitro by testosterone and 5-alpha-dihydrotestosterone is dependent on the localization of the sebaceous glands. Akamatsu H, Zouboulis CC, Orfanos CE. J Invest Dermatol. 1992 Oct;99(4):509-11.
296-Spironolactone directly inhibits proliferation of cultured human facial sebocytes and acts antagonistically to testosterone and 5 alpha-dihydrotestosterone in vitro. Akamatsu H, Zouboulis CC, Orfanos CE. J Invest Dermatol. 1993 May;100(5):660-2.
297-Characterization, expression, and immunohistochemical localization of 5 alpha-reductase in human skin. Luu-The V, Sugimoto Y, Puy L, Labrie Y, Lopez Solache I, Singh M, Labrie F. J Invest Dermatol. 1994 Feb;102(2):221-6. 298-Steroid 5 alpha-reductase: two genes/two enzymes. Russel DW, Wilson JD. Annu Rev Biochem. 1994;63:25-61. 299-Activity of the type 1 5 alpha-reductase exhibits regional differences in isolated sebaceous glands and whole skin. Thiboutot D, Harris G, Iles V, Cimis G, Gilliland K, Hagari S. J Invest Dermatol. 1995 Aug;105(2):209-14. 300-Different levels of 5alpha-reductase type I and II, aromatase, and androgen receptor in hair follicles of women and men with androgenetic alopecia. Sawaya ME, Price VH. J Invest Dermatol. 1997 Sep;109(3):296-300. 301-5α-Reductase isozymes and aromatase mRNA levels in plucked hair from young women with female pattern hair loss. Sánchez P, Serrano-Falcón C, Torres JM, Serrano S, Ortega E. Arch Dermatol Res. 2018 Jan;310(1):77-83. 302-Androgenic correlates of genetic variation in the gene encoding 5alpha-reductase type 1. Ellis JA, Panagiotopoulos S, Akdeniz A, Jerums G, Harrap SB. J Hum Genet. 2005;50(10):534-7. 303-Variants in the 5alpha-reductase type 1 and type 2 genes are associated with polycystic ovary syndrome and the severity of hirsutism in affected women. Goodarzi MO, Shah NA, Antoine HJ, Pall M, Guo X, Azziz R. J Clin Endocrinol Metab. 2006 Oct;91(10):4085-91. 304-Association of genetic variants in the two isoforms of 5α-reductase, SRD5A1 and SRD5A2, in lean patients with polycystic ovary syndrome. Graupp M, Wehr E, Schweighofer N, Pieber TR, Obermayer-Pietsch B. Eur J Obstet Gynecol Reprod Biol. 2011 Aug;157(2):175-9. 305-Origin of plasma androstanediol glucuronide in men. Moghissi E, Ablan F, Horton R. J Clin Endocrinol Metab. 1984 Sep;59(3):417-21. 306-Androgen glucuronides, instead of testosterone, as the new markers of androgenic activity in women. Labrie F, Bélanger A, Bélanger P, Bérubé R, Martel C, Cusan L, Gomez J, Candas B, Castiel I, Chaussade V, Deloche C, Leclaire J. J Steroid Biochem Mol Biol. 2006 Jun;99(4-5):182-8. 307-Inactivation of androgens by UDP-glucuronosyltransferase enzymes in humans. Bélanger A, Pelletier G, Labrie F, Barbier O, Chouinard S. Trends Endocrinol Metab. 2003 Dec;14(10):473-9. 308-Inactivation by UDP-glucuronosyltransferase enzymes: the end of androgen signaling. Chouinard S, Yueh MF, Tukey RH, Giton F, Fiet J, Pelletier G, Barbier O, Bélanger A. J Steroid Biochem Mol Biol. 2008 Apr;109(3-5):247-53. 309-Risk of venous thromboembolism in women with polycystic ovary syndrome: a population-based matched cohort analysis. Bird ST, Hartzema AG, Brophy JM, Etminan M, Delaney JA. CMAJ. 2013 Feb 5;185(2):E115-20. 310-Combined hormonal contraception and the risk of venous thromboembolism: a guideline. Practice Committee of the American Society for Reproductive Medicine. Fertil Steril. 2017 Jan;107(1):43-51. 311-Different combined oral contraceptives and the risk of venous thrombosis:systematic review and network meta-analysis. Stegeman BH, de Bastos M, Rosendaal FR, van Hylckama Vlieg A, Helmerhorst FM, Stijnen T, Dekkers OM. BMJ. 2013 Sep 12;347:f5298. 312-Pills-related severe adverse events: A case report in Taiwan. Chen CH, Chin HY et al. Taiwan J Obstet Gynecol . 2016 Aug;55(4):588-90. 313-Oral contraceptives and breast cancer risk among younger women. Brinton LA, Daling JR, Liff JM et al. J Nath Cancer Inst. 1995 Jun 7;87(11):827-35. 314-Contemporary Hormonal Contraception and the Risk of Breast Cancer. Mørch LS, Skovlund CW, Hannaford PC, Iversen L, Fielding S, Lidegaard Ø. N Engl J Med. 2017 Dec 7;377(23):2228-2239. 315-Breast cancer and hormonal contraceptives: collaborative reanalysis of individual data on 53 297 women with breast cancer and 100 239 women without breast cancer from 54 epidemiological studies.Collaborative Group on Hormonal Factors in Breast Cancer.Lancet. 1996 Jun 22;347(9017):1713-27. 316-Breast cancer among young U.S. women in relation to oral contraceptive use. White E, Malone KE, Weiss NS, Daling JR. J Natl Cancer Inst. 1994 Apr 6;86(7):505-14. 317-Clinical review: Insulin sensitizers for the treatment of hirsutism: a systematic review and metaanalyses of randomized controlled trials. Cosma M, Swiglo BA, Flynn DN, Kurtz DM, Labella ML, Mullan RJ, Elamin MB, Erwin PJ, Montori VM. J Clin Endocrinol Metab. 2008 Apr;93(4):1135-42.318- Treatment Options for Hirsutism: A Systematic Review and Network Meta- Analysis . Barrionuevo P, Nabhan M, Altayar O, Wang Z, Erwin PJ, Asi N, Martin KA, Murad MH. J Clin Endocrinol Metab. 2018 Apr 1;103(4):1258-1264.
319-The endocrine effects of spironolactone used as an antiandrogen. Young RL, Goldzieher JW, Elkind-Hirsch K. Fertil Steril. 1987 Aug;48(2):223-8. 320-Oral Spironolactone for Acne Vulgaris in Adult Females: A Hybrid Systematic Review. Layton AM, Eady EA, Whitehouse H, Del Rosso JQ, Fedorowicz Z, van Zuuren EJ. Am J Clin Dermatol. 2017 Apr;18(2):169-191. 321-Guidelines of care for the management of acne vulgaris. Zaenglein AL, Pathy AL, Schlosser BJ, Alikhan A, Baldwin HE, Berson DS, Bowe WP, Graber EM, Harper JC, Kang S,Keri JE, Leyden JJ, Reynolds RV, Silverberg NB, Stein Gold LF, Tollefson MM, Weiss JS, Dolan NC, Sagan AA,Stern M, Boyer KM, Bhushan R. J Am Acad Dermatol. 2016 May;74(5):945-73.e33. 322-Practical management of acne for clinicians: An international consensus from the Global Alliance to Improve Outcomes in Acne. Thiboutot DM, Dréno B, Abanmi A, Alexis AF, Araviiskaia E, Barona Cabal MI, Bettoli V, Casintahan F, Chow S, da Costa A, El Ouazzani T, Goh CL, Gollnick HPM, Gomez M, Hayashi N, Herane MI, Honeyman J, Kang S, Kemeny L,Kubba R, Lambert J, Layton AM, Leyden JJ, López-Estebaranz JL, Noppakun N, Ochsendorf F, Oprica C, Orozco B, Perez M, Piquero-Martin J, See JA, Suh DH, Tan J, Lozada VT, Troielli P, Xiang LF. J Am Acad Dermatol. 2018 Feb;78(2 Suppl 1):S1-S23.e1. 323-Spironolactone and risk of incident breast cancer in women older than 55 years: retrospective, matched cohort study. Mackenzie IS, Macdonald TM, Thompson A, Morant S, Wei L. BMJ. 2012 Jul 13;345:e4447. 324-Spironolactone use and risk of incident cancers: a retrospective, matched cohort study. Mackenzie IS, Morant SV, Wei L, Thompson AM, MacDonald TM. Br J Clin Pharmacol. 2017 Mar;83(3):653-663. 325-Spironolactone use and the risk of breast and gynecologic cancers. Biggar RJ, Andersen EW, Wohlfahrt J, Melbye M. Cancer Epidemiol. 2013 Dec;37(6):870-5. 326-Adverse Effects and Safety of 5-alpha Reductase Inhibitors (Finasteride, Dutasteride): A Systematic Review. Hirshburg JM, Kelsey PA, Therrien CA, Gavino AC, Reichenberg JS. J Clin Aesthet Dermatol. 2016 Jul;9(7):56-62. 327-Balding hair follicle dermal papilla cells contain higher levels of androgen receptors than those from non-balding scalp. hibberts NA, Howell AE, Randall VA. J Endocrinol. 1998Jan;156(1):59-65. 328-Evidence-based (S3) guideline for the treatment of androgenetic alopecia in women and in men – short version. Kanti V, Messenger A, Dobos G, Reygagne P, Finner A, Blumeyer A, Trakatelli M, Tosti A, Del Marmol V, Piraccini BM,Nast A, Blume-Peytavi U. J Eur Acad Dermatol Venereol. 2018 Jan;32(1):11-22. 329-A review of medical and surgical treatment options for androgenetic alopecia. Rousso DE, Kim SW. JAMA Facial Plast Surg. 2014 Nov-Dec;16(6):444-50. 330-Biofibre® artificial hair implant: Retrospective study on 1,518 patients with alopecia and present role in hair surgery. Satolli F, Rovesti M, Bogdan Moran AB, Griselli G, Agarwal M, Amr Abdel-Hakim Rateb S, Gianfaldoni S, Lozev I, Pidakev I,Feliciani C1, Tchernev G. Dermatol Ther. 2019 Jul;32(4):e12985. 331-Long term follow-up of patients with polycystic ovarian syndrome after laparoscopic ovarian drilling: clinical outcome. Amer SA, Gopalan V, Li TC, Ledger WL, Cooke ID. Hum Reprod. 2002 Aug;17(8):2035-42. 332-Effects of laparoscopic ovarian drilling on adrenal steroids in polycystic ovary syndrome patients with and without hyperinsulinemia. Saleh A, Morris D, Tan SL, Tulandi T. Fertil Steril. 2001 Mar;75(3):501-4. 333-Success of laparoscopic ovarian wedge resection is related to obesity, lipid profile, and insulin levels. Duleba AJ, Banaszewska B, Spaczynski RZ, Pawelczyk L. Fertil Steril. 2003 Apr;79(4):1008-14. 334-Functional integrity of granulosa cells from polycystic ovaries. Almahbobi G, Anderiesz C, Hutchinson P, McFarlane JR, Wood C, Trounson AO. Clin Endocrinol (Oxf). 1996 May;44(5):571-80.Bunları da İnceleyin;
 Polikistik Over
Polikistik Over