Dr. Burak Hacıhanefioğlu
polikistikover.net internet sitesinde yer alan tıp içerikli yazı ve videoların tümü Kadın Hastalıkları ve Doğum Uzmanı Dr. Burak Hacıhanefioğlu tarafından hazırlanmış olup, telif hakları yasal koruma altına alınmıştır. İzinsiz kaynak gösterilerek dahi başka bir yerde yayınlanamaz.
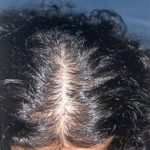
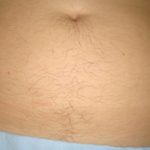
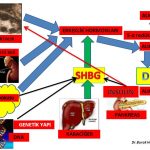
Erkeklerde görüldüğü gibi bıyık, çene, favori, boyun, ense, göğüs arası, göğüs ucu, bel, omuz, sırt, karın, kol ve bacak bölgelerinde bulunan kılların miktarında artış, koyulaşma, kalınlaşma ve sertleşme olması polikistik over sendromu olan kadınların bir kısmında erkeklik hormonlarının (testosteron, dihidrotestosteron) miktarında artış ve erkeklik hormonlarına bağlanarak onları etkisiz hale getiren Sex Hormone Binding Globulin (SHBG) miktarındaki azalmaya bağlı olarak ortaya çıkmaktadır(1,2,3,4,5,6,7).
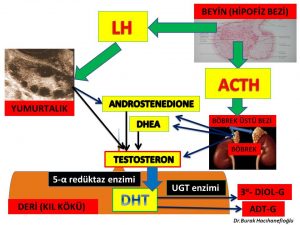
Erkeklik hormonlarının (testosteron, dihidrotestosteron) büyük bir kısmı böbrek üstü bezinde (Adrenal Gland) üretilen DHEA ve Androstenedione hormonlarını hammadde olarak kullanarak kıl kökleri ve yağ bezlerinin bulunduğu deri gibi aynı zamanda erkeklik hormonlarının (testosteron, dihidrotestosteron) hedefi olan organlarda üretilirken ancak küçük bir kısmı yumurtalık ve böbrek üstü bezinde üretilmektedir (Intracrinology)(8,9). Kan dolaşımında bulunan testosteron miktarı sadece yumurtalık ve böbrek üstü bezinden direk olarak salınan miktarı göstermektedir. Kadınlarda testosteron hormonunun büyük kısmının üretildiği deri, yağ dokusu, meme gibi organlardan ancak küçük bir miktar (%10) testosteron kan dolaşımına girmektedir(10). Kan dolaşımına girmeyen testosteron hormonunun büyük çoğunluğu ise 5- α reduktaz (reductase) enzimi tarafından üretildiği kıl köklerinde tüylenme artışına neden olan dihidrotestosteron (dhydrotestosterone) hormonuna dönüşmektedir(11,12,18). Dihidrotestosteron hormonu testosteron hormonundan 10 kat daha güçlü bir etkiye sahiptir(50). Testosteron hormonunu dihidrotestosteron hormonuna dönüştüren 5- α reduktaz (reductase) enziminin 2 formu (isozyme) vardır(52,53). 5- α reduktaz (reductase) tip 1 en çok deri hücresinde (epidermis), kıl köklerinde, yağ (sebaceous) bezlerinde ve ter bezlerinde bulunmaktadır. 5- α reduktaz (reductase) tip 2 ise en çok saçlı deride bulunmaktadır(53,54,55). 5- α reduktaz (reductase) enziminin etkinliğinde (activity) büyük oranda anneden kızına genetik geçiş bulunmaktadır(51). Polikistik over sendromu olan kadınların bir kısmında 5- α reduktaz (reductase) tip 1 enziminin üretimini sağlayan SRD5A1 geninin belirli bölgelerinde genetik farklılıklar (variant) vardır. Bu genetik değişiklikler 5- α reduktaz (reductase) tip 1 enziminin etkinliğini (activity) arttırarak tüylenme artışına neden olmaktadır(56,57,58).
Dihidrotestosteron hormonunun da testosteron hormonu gibi büyük çoğunluğu (%90) kan dolaşımına girmemektedir. Kan dolaşımına girmeyen dihidrotestosteron hormonu üretildiği deri hücresinde bulunan kıl köklerinde tüylenme artışına neden olmaktadır (12,13). Deride (cilt) üretilen dihidrotestosteron (DHT) hormonunun büyük çoğunluğu deri hücresini korumak amacıyla UGT- enzimi ile herhangi bir hormon etkisi olmayan ürünler (metabolit) olan 3 α- androstanediol glucuronide (3α diol G) ve androsterone Glucuronide (ADT-G) dönüşerek deri hücresinden kan dolaşımına girmektedir(14,15,17). Kan dolaşımına katılan 3 α- androstanediol glucuronide (3α diol G) ve androsterone Glucuronide (ADT-G) idrar yolu ile vücuttan atılmaktadır(14, 15,16,17).
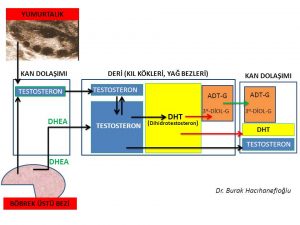
∗Kan dolaşımında bulunan testosteron ve dihidrotestosteron sadece buz dağının görünen küçük kısmıdır. Kıl köklerinin bulunduğu deri hücresinde üretilen kan dolaşımına girmeyen buz dağının görünmeyen büyük kısmı ise 3 α- androstanediol glucuronide (3α diol G) ve androsterone Glucuronide (ADT-G) dönüşerek deri hücresinden kan dolaşımına girmektedir. Polikistik over sendromu’nda erkeklik hormonlarının miktarındaki artışı ve tüylenme artışını değerlendirirken buz dağının görünmeyen kısmını da unutmamamız gerekmektedir.
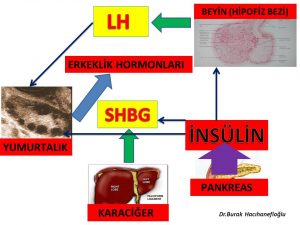
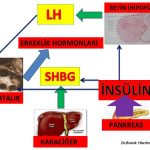
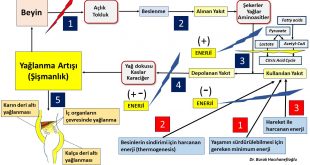
Polikistik over sendromu’nda fazla kilolu ve şişman olan veya normal kilolu fakat bel çevresi kalın (erkek tipi yağlanma) olan kadınların büyük çoğunluğunda insülin direnci vardır (19,20,21,22). İnsülin direnci olan kişilerde pankreas bu direnci yenmek için fazla miktarda insülin üretir. Bunun sonucunda kan dolaşımında bulunan insülin miktarı artar (Hiperinsülinemi). Polikistik over sendromu alt gruplarının (A,B,C) hepsinde insülin direnci görülebilmektedir. İnsülin direncine bağlı olarak fazla miktarda üretilen insülin hormonunun polikistik over sendromu olan kadınlarda tüylenme artışına neden olan etki mekanizmaları aşağıda belirtilmiştir;
1-Kan dolaşımında fazla miktarda bulunan İnsülin hormonu doğrudan yumurtalığa giderek yumurtalıkta erkeklik hormonlarının üretimini arttırmaktadır (hiperandrogenism)(23,24,25,26,27,26,27,28). 2-Kan dolaşımında fazla miktarda bulunan insülin hormonu beyinde yer alan hipofiz bezinde erkeklik hormonlarının yumurtalıkta yapılmasını sağlayan LH (luteinizing hormon) üretimini arttırmaktadır(29,30,31,32). LH (luteinizing hormon) miktarının artması erkeklik hormonlarının yapımını arttırmaktadır (hiperandrogenism)(28,30,32,33). Yumurtalıklarda erkeklik hormonları (androgen) teka hücrelerinde üretilmektedir(30,37). İnsülin ve LH’ nın teka hücrelerinde erkeklik hormonlarının üretimini arttırmasının yanında polikistik over sendromu olan kadınların bir kısmında hem teka hücrelerinin sayısı fazla olduğu için hem de her bir teka hücresinde erkeklik hormonu üreten enzimin (CYP17 ) üretim kapasitesi fazla olduğu için (hyperactivity) daha fazla erkeklik hormonu üretilmektedir(29,30,37,38,39,40,41). 3-Karaciğerde üretilen sex hormone binding globulin (SHBG) erkeklik hormonlarına bağlanarak kan dolaşımında serbest bulunan etkin formların (serbest testosteron) miktarını azaltmaktadır(34,35). Kan dolaşımında fazla miktarda bulunan insülin hormonu sex hormone binding globulin (SHBG) üretimini azaltmaktadır(36).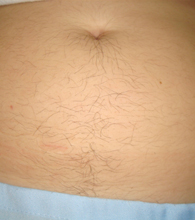
Vücutlarında yağ dokusu artışı (adiposity) olan fazla kilolu, şişman kadınlar ile normal kilolu fakat bel çevresi kalın (erkek tipi yağlanma) olan kadınların büyük çoğunluğunda insülin direnci nedeniyle artan insülin hormonu karaciğerde SHBG üretimini azaltarak kan dolaşımında bulunan SHBG miktarını azaltmaktadır (19,20,21,22,36,42,43,44,45).
Tiroid bezinin az çalışması (Hypothyroidism) metabolizmayı yavaşlatarak enerji tüketimini azaltır (vücut sıcaklığının azalması gibi)(46). Enerji tüketiminin azalması kilo ve yağ dokusu artışına neden olduğu için SHBG miktarını azaltır. Kan dolaşımında SHBG miktarının azalması erkeklik hormonlarının serbest bulunan etkin formlarının (serbest testosteron) miktarını arttırmaktadır(47,49). Fazla kilolu kadınlarda olduğu gibi normal kilolu veya zayıf kadınlarda da tiroid bezinin az çalışması (Hashimoto’s Thyroiditis) SHBG üretimini azaltarak tüylenme artışına neden olabilmektedir(48).
Kan dolaşımında bulunan sex hormone binding globulin (SHBG) miktarının yarıya yakınını anneden kızına genetik geçiş belirlemektedir (59). Polikistik over sendromu olan kadınların bir kısmında SHBG yapımını sağlayan genin belirli bölgelerinde genetik farklılıklar (variant) vardır. Bu genetik değişikliklerin bir kısmı SHBG’nin yıkılmasını azaltarak SHBG miktarının artmasına neden olduğu için kan dolaşımında serbest bulunan erkeklik hormonlarının etkin formlarının (serbest testosteron) miktarını azaltmaktadır(60,64). Böylece bu genetik değişiklikler tüylenme artışına karşı koruyucu bir etki göstermektedir. Fakat, bazı genetik değişiklikler ise SHBG nin kan dolaşımında bulunan miktarını azaltarak tüylenme artışına neden olmaktadır(61,62,63,64).
Tedavi;
Tüylenme artışı tedavisine başlamadan önce tüylenme artışının kaynağının yukarıda anlattığım aşamalardan hangisi ya da hangileri olduğu belirlenmelidir. Polikistik over sendromu olan kadınlarda epilasyon, ağda, tıraş gibi fiziksel yöntemler tüylenme artışı şikayetinde geçici bir iyileşme sağlamakla birlikte, bu yöntemlerle yapılan tedavi sonrasında tüylenme artışı şikayeti çoğunlukla tekrarlamaktadır. Bu durum fiziksel yöntemlerin genellikle tekrar tekrar, düzensiz bir şekilde kullanılmasına neden olmaktadır.
∗ Tüylenme artışı tedavisinin kalıcı olması için lazer ve iğneli epilasyon gibi fiziksel yöntemlerin tüylenme artışının nedeni bilinmeden kullanılması doğru değildir(88,89,90).
∗Lazer ve foto epilasyon gibi fiziksel yöntemler tüylenme artışına neden olan erkeklik hormonları (testosteron, dihidrotestosteron) ve onların hammaddelerinde (DHEA, androstenedion) görülen artışın (hiperandrogenism) tedavisi ile birlikte uygulandığı zaman faydalı olmaktadır(88,89,90). Aksi taktirde epilasyonun etkisi az olmakta ve epilasyon sonrası tüylenme artışı tekrarlamaktadır.
∗Polikistik over sendromu olan kadınların bir kısmında lazer epilasyon veya foto epilasyon uygulanan bölge ve onun çevresinde genellikle yüz ve boyun bölgelerinde tam tersine daha fazla tüylenme artışına (paradoxical hypertrichosis) neden olmaktadır(85,86,87).
Uzun etkili ve kalıcı bir tedavi etkinliğinin olmamasına ve bacak damarlarının pıhtı ile tıkanması (derin ven trombozu) ve ordan kopan pıhtı parçasının da akciğer damarlarını tıkaması (pulmoner emboli) ve meme kanseri ihtimalini arttırması gibi bir kısmı hayati tehlikeye sahip olan bir çok yan etkiye sahip olmasına rağmen doğum kontrol hapları tüylenme artışı tedavisinde halen yaygın olarak kullanılmaktadır(65,66,67,68,69,70,71,72).
∗Polikistik over sendromu’nda tüylenme artışı tedavisinde doğum kontrol hapı kullanılması doğru değildir.
Tedavi Yöntemleri;
Polikistik over sendromu’nda tüylenme artışı tedavisinde en güçlü erkeklik hormonu olan dihidrotestosteron hormonuna dönüşen erkeklik hormonlarının (testosteron, androstenedione, DHEAS) etkinliğinin ve miktarının azaltılması, dihidrotestosteron hormonuna dönüşümün azaltılması ve Sex Hormon Binding Globulin miktarının arttırılması sonucunda kan dolaşımında serbest bulunan erkeklik hormonlarının etkin formlarının (serbest testosteron) miktarının azaltılması tedavinin temel amacıdır.
1-İnsülin direnci olan kadınlarda insülin duyarlılığının ilaç tedavisi ile arttırılmasına bağlı olarak kan dolaşımında bulunan insülin miktarının azalması yumurtalıkta fazla miktarda üretilen erkeklik hormonlarını (androstenedione, testosteron) azaltmaktadır(73,74). İnsülin direncinin azalması aynı zamanda karaciğerde üretilen SHBG miktarını arttırmakta ve erkeklik hormonlarının serbest dolaşan etkin formlarının (serbest testosteron ) miktarının azalmasına neden olmaktadır(73,74).
2-Kan dolaşımında bulunan erkeklik hormonlarının bir kısmı kıl köklerinde alıcılara (androgen receptor) tutunarak tüylenme artışına neden olmaktadır. Erkeklik hormonlarının kıl köklerindeki alıcılara tutunmasının engellenmesi (androgen receptor antagonist) diğer bir tedavi seçeneğidir(75,76,77). Bu amaçla kullanılan ilaçların (androgen receptor antagonist) doğum kontrol hapları gibi hayati tehlikeye sahip yan etkileri ( bacak damarlarının pıhtı ile tıkanması ve ordan kopan pıhtı parçasının da akciğer damarlarını tıkaması ve meme kanseri) yoktur(81,82,83). 3-Alıcılara(receptor) tutunarak deri hücresine giren testosteron ile deri hücresinde üretilen testosteron hormonunun büyük çoğunluğu 5- α reduktaz (reductase) enzimi tarafından kıl köklerinde tüylenme artışına neden olan dihidrotestosteron (dhydrotestosterone) hormonuna dönüşmektedir(11,12,18). 5- α reduktaz (reductase) enziminin bu etkisinin engellenmesi ( 5- α reductase inhibitor) de bir tedavi seçeneğidir(74,76,77). Bu amaçla kullanılan ilaçların ( 5-α reductase inhibitor) doğum kontrol hapları gibi hayati tehlikeye sahip yan etkileri ( bacak damarlarının pıhtı ile tıkanması ve ordan kopan pıhtı parçasının da akciğer damarlarını tıkaması ve meme kanseri) yoktur(84).
4-Polikistik over ameliyatı miktarı ve etkinliği artmış olan erkeklik hormonlarının (testosteron, dihidrotestosteron) etkinliğinin ve miktarının azaltılması ve insülin duyarlılığının artması sonucunda SHBG miktarını arttırarak etki gösteren bir tedavi seçeneğidir(78,79,80).
5-Düzenli olarak yapılan spor (yürüyüş ve yüzme gibi) kilodan bağımsız olarak yani kişi fazla kilolu olsa dahi vücutta bulunan yağ dokusunun yerini kas dokusunun almasını sağlar. Yağ dokusunun azalması hem erkeklik hormonlarının üretimini azaltarak, hem de SHBG miktarını arttırarak etki gösteren yardımcı bir tedavi seçeneğidir. 6-Fazla miktarda tüketilen karbonhidratlar proteinlerden farklı olarak yumurtalık ve böbrek üstü bezi gibi erkeklik hormonlarının üretildiği bölgelerden biri olan yağ dokusu olarak depolanmaktadır. Bu nedenlerle karbonhidrat miktarı düşük, buna karşılık protein miktarı fazla olan besinleri tüketilmesi hem erkeklik hormonlarının üretimini düşürerek, hem de SHBG miktarını arttırarak etki gösteren yardımcı bir tedavi seçeneğidir.∗Yukarıda anlattığım tedavi seçeneklerinden hangisinin uygulanacağı tüylenme artışının kaynağına, şiddetine, süresine, vücut dağılımına ve başka şikayetlerin (saç dökülmesi, sivilce, adet düzensizliği) birlikte olup olmamasına bağlı olarak kişiden kişiye göre değişmektedir. Çoğunlukla birden fazla tedavi seçeneği birlikte uygulanmaktadır.
Kaynaklar
1-Zawadski JK, Dunaif A. Diagnostic criteria for polycystic ovary syndrome;towards a rational approach. In: Dunaif A, Givens JR, Haseltine F, editors. Polycystic ovary syndrome. Vol. 1992. Boston, MA: Black-well Scientific; 1992. pp. 377–84. 2-Rotterdam ESHRE/ASRM-sponsored PCOS Consencus Workshop Group. Revised 2003 consensus on diagnostic criteria and long-term health risks relatedto polycystic ovary syndrome. Fertil Steril. 2004 Jan;81(1):19-25. 3- Rotterdam ESHRE/ASRM-sponsored PCOS Consencus Workshop Group. Revised 2003 consensus on diagnostic criteria and long-term health risks related to polycystic ovary syndrome. Hum Reprod. 2004 Jan;19(1):41-7. 4-The Androgen Excess and PCOS Society criteria for the polycystic ovary syndrome: the complete task force report. Azziz R, Dewailly D, Diamanti-Kandarakis E, Escobar-Morrreale HF, Futterweit W, Janssen OE, Legro RS, Norman RJ, Taylor AE, Witchel SF. Fertil Steril. 2009 Feb;91(2):456-88. 5-Amenorrhea associated with bilateral polycystic ovaries. Stein IF, Leventhal ML. Am J Obstet Gynecol. 1935, 29(2):181-191. 6-Polycystic ovary syndrome: the spectrum of the disorder in 1741 patients. Balen AH , Conway GS, Kaltsas G, Techatrasak K, Manning PJ, West C, Jacobs HS. Hum Reprod. 1995 Aug;10(8):2107-11. 7-Clinical assessment of body hair growth in women. Ferriman D, Galwey JD. J Clin Endocrinol Metab. 1961 Nov;21:1440-7. 8-Intracrinology. Labrie F. Mol Cell Endocrinol. 1991 Jul;78(3):C113-8. 9-Endocrine and intracrine sources of androgens in women: inhibition of breast cancer and other roles of androgens and their precursor dehydroepiandrosterone. Labrie F, Luu-The V, Labrie C, Bélanger A, Simard J, Lin SX, Pelletier G. Endocr Rev. 2003 Apr;24(2):152-82. 10-DHEA and its transformation into androgens and estrogens in peripheral target tissues: intracrinology. Labrie F, Luu-The V, Labrie C, Simard J. Front Neuroendocrinol. 2001 Jul;22(3):185-212. 11-Sexual hormones in human skin. Zouboulis CC, Chen WC, Thornton MJ, Qin K, Rosenfield R. Horm Metab Res. 2007 Feb;39(2):85-95. 12-Dihydrotestosterone is a peripheral paracrine hormone. Horton R. J Androl. 1992 Jan-Feb;13(1):23-7. 13-Origin of plasma androstanediol glucuronide in men. Moghissi E , Ablan F, Horton R. J Clin Endocrinol Metab. 1984 Sep;59(3):417-21. 14-Quantitative determination of beta-glucuronidase in sweat gland and other skin components in cystic fibrosis. Gibbs GE, Friffin GD.J Invest Dermatol. 1968 Sep;51(3):200-3. 15-Inactivation of androgens by UDP-glucuronosyltransferase enzymes in humans. Bélanger A, Pelletier G, Labrie F, Barbier O, Chouinard S. Trends Endocrinol Metab. 2003 Dec;14(10):473-9. 16-Inactivation by UDP-glucuronosyltransferase enzymes: the end of androgen signaling. Chouinard S, Yueh MF, Tukey RH, Giton F, Fiet J, Pelletier G, Barbier O, Bélanger A. J Steroid Biochem Mol Biol. 2008 Apr;109(3-5):247-53. 17-Androgen glucuronides, instead of testosterone, as the new markers of androgenic activity in women. Labrie F, Bélanger A, Bélanger P, Bérubé R, Martel C, Cusan L, Gomez J, Candas B, Castiel I, Chaussade V, Deloche C, Leclaire J. J Steroid Biochem Mol Biol. 2006 Jun;99(4-5):182-8. 18-Tissue distribution and ontogeny of steroid 5 alpha-reductase isozyme expression. Thigpen AE, Silver RI, Guileyardo JM, Casey ML, McConnell JD, Russell DW. J Clin Invest. 1993 Aug;92(2):903-10. 19-Profound peripheral insulin resistance, independent of obesity, in polycystic ovary syndrome. Dunaif A, Segal KR, Futterweit W, Dobrjansky A. Diabetes. 1989 Sep;38(9):1165-74. 20-Prediction models for insulin resistance in the polycystic ovary syndrome. Gennarelli G, Holte J, Berglund L, Berne C, Massobrio M, Lithell H. Hum Reprod. 2000 Oct;15(10):2098-102. 21-Use of fasting blood to assess the prevalence of insulin resistance in women with polycystic ovary syndrome. Carmina E , Lobo RA. Fertil Steril. 2004 Sep;82(3):661-5. 22-Prevalence of insulin resistance in the polycystic ovary syndrome using the homeostasis model assessment. DeUgarte CM, Bartolucci AA, Azziz R. Fertil Steril. 2005 May;83(5):1454-60. 23-Insulin stimulates testosterone biosynthesis by human thecal cells from women with polycystic ovary syndrome by activating its own receptor and using inositolglycan mediators as the signal transduction system. Nestler JE, Jakubowicz DJ, de Vargas AF, Brik C, Quintero N, Medina F. J Clin Endocrinol Metab. 1998 Jun;83(6):2001-5. 24-Insulin stimulates androgen accumulation in incubations of human ovarian stroma and theca. Barbieri RL, Makris A, Ryan KJ. Obstet Gynecol. 1984 Sep;64(3 Suppl):73S-80S. 25-Insulin stimulates androgen accumulation in incubations of ovarian stroma obtained from women with hyperandrogenism. Barbieri RL, Makris A, Randall RW, Daniels G, Kistner RW, Ryan KJ. J Clin Endocrinol Metab. 1986 May;62(5):904-10. 26-Metabolic regulation of androgen production by human thecal cells in vitro. Nahum R, Thong KJ, Hillier SG. Hum Reprod. 1995 Jan;10(1):75-81. 27-Regulation of androgen production in cultured human thecal cells by insulin-like growth factor I and insulin. Bergh C , Carlsson B, Olsson JH, Selleskog U, Hillensjö T. Fertil Steril. 1993 Feb;59(2):323-31. 28-Differential effects of insulin sensitivity on androgens in obese women with polycystic ovary syndrome or normal ovulation. Asagami T, Holmes TH, Reaven G. Metabolism. 2008 Oct;57(10):1355-60. 29-Thecal cell sensitivity to luteinizing hormone and insulin in polycystic ovarian syndrome. Cadagan D, Khan R, Amer S. Reprod Biol. 2016 Mar;16(1):53-60. 30-Hypersecretion of androstenedione by isolated thecal cells from polycystic ovaries. Gilling-Smith C, Willis DS, Beard RW, Franks S. J Clin Endocrinol Metab. 1994 Oct;79(4):1158-65. 31-Insulin action in the normal and polycystic ovary. Franks S, Gilling-Smith C, Watson H, Willis D. Endocrinol Metab Clin North Am. 1999 Jun;28(2):361-78. 32-Hyperinsulinemia amplifies GnRH agonist stimulated ovarian steroid secretion in women with polycystic ovary syndrome. Tosi F, Negri C, Perrone F, Dorizzi R, Castello R, Bonora E, Moghetti P. J Clin Endocrinol Metab. 2012 May;97(5):1712-9. 33-Oestradiol feedback stimulation of androgen biosynthesis by human theca cells. Gilling-Smith C, Willis DS, Franks S. Hum Reprod. 1997 Aug;12(8):1621-8. 34-Secretion of testosterone-estradiol-binding globulin by a human hepatoma-derived cell line. Khan MS, Knowles BB, Aden DP, Rosner W. J Clin Endocrinol Metab. 1981 Aug;53(2):448-9. 35-Molecular properties of corticosteroid binding globulin and the sex-steroid binding proteins. Hammond GL. Endocr Rev. 1990 Feb;11(1):65-79. 36-Regulation of production and secretion of sex hormone-binding globulin in HepG2 cell cultures by hormones and growth factors. Loukovaara M, Carson M, Adlercreutz H. J Clin Endocrinol Metab. 1995 Jan;80(1):160-4. 37-The ovarian androgen producing cells: a review of structure/function relationships. Erickson GF, Magoffin DA, Dyer CA, Hofeditz C. Endocr Rev. 1985 Summer;6(3):371-99. 38-Evidence for a primary abnormality of thecal cell steroidogenesis in the polycystic ovary syndrome. Gilling-Smith C, Story H, Rogers V, Franks S. Clin Endocrinol (Oxf). 1997 Jul;47(1):93-9. 39-The biochemical basis for increased testosterone production in theca cells propagated from patients with polycystic ovary syndrome. Nelson VL, Qin KN, Rosenfield RL, Wood JR, Penning TM, Legro RS, Strauss JF 3rd, McAllister JM. J Clin Endocrinol Metab. 2001 Dec;86(12):5925-33. 40-Luteinizing hormone receptor, steroidogenesis acute regulatory protein, and steroidogenic enzyme messenger ribonucleic acids are overexpressed in thecal and granulosa cells from polycystic ovaries. Jakimiuk AJ, Weitsman SR, Navab A, Magoffin DA. J Clin Endocrinol Metab. 2001 Mar;86(3):1318-23. 41-Ovarian enzyme activities in women with polycystic ovary syndrome. Magoffin DA. Fertil Steril. 2006 ul;86 Suppl 1:S9-S11. 42-The relationship of insulin to sex hormone-binding globulin: role of adiposity. Peiris AN , Sothmann MS, Aiman EJ, Kissebah AH. Fertil Steril. 1989 Jul;52(1):69-72. 43-Interrelation between plasma sex hormone-binding globulin and plasma insulin in healthy adult women: the telecom study. Preziosi P, Barrett-Connor E, Papoz L, Roger M, Saint-Paul M, Nahoul K, Simon D. J Clin Endocrinol Metab. 1993 Feb;76(2):283-7. 44-Characterization of obese women with reduced sex hormone-binding globulin concentrations. Pasquali R, Casimirri F, Platè L, Capelli M. Horm Metab Res. 1990 May;22(5):303-6. 45-Suppression of serum insulin by diazoxide reduces serum testosterone levels in obese women with polycystic ovary syndrome. Nestler JE, Barlascini CO, Matt DW, Steingold KA, Plymate SR, Clore JN, Blackard WG. J Clin Endocrinol Metab. 1989 Jun;68(6):1027-32. 46-Obesity and thyroid function. Reinehr T. Mol Cell Endocrinol. 2010 Mar 25;316(2):165-71. 47-The link between metabolic features and TSH levels in polycystic ovary syndrome is modulated by the body weight: an euglycaemic-hyperinsulinaemic clamp study. Tagliaferri V, Romualdi D, Guido M, Mancini A, De Cicco S, Di Florio C, Immediata V, Di Segni C, Lanzone A. Eur J Endocrinol. 2016 Nov;175(5):433-41. 48-Subclinical Hypothyroidism in Polycystic Ovary Syndrome: A Systematic Review and Meta-Analysis. Ding X, Yang L, Wang J, Tang R, Chen Q, Pan J, Yang H, Chen X, Chen Z, Mu L. Front Endocrinol (Lausanne). 2018 Nov 27;9:700. 49-Focus on BMI and subclinical hypothyroidism in adolescent girls first examined for amenorrhea or oligomenorrhea. The emerging role of polycystic ovary syndrome. Nezi M, Christopoulos P, Paltoglou G, Gryparis A, Bakoulas V, Deligeoroglou E, Creatsas G, Mastorakos G. J Pediatr Endocrinol Metab. 2016 Jun 1;29(6):693-702. 50-Relative binding affinity of anabolic-androgenic steroids: comparison of the binding to the androgen receptors in skeletal muscle and in prostate, as well as to sex hormone-binding globulin. Saartok T, Dahlberg E, Gustafsson JA. Endocrinology. 1984 Jun;114(6):2100-6. 51-Quantitating genetic and nongenetic factors that determine plasma sex steroid variation in normal male twins. Meikle AW, Bishop DT, Stringham JD, West DW. Metabolism. 1986 Dec;35(12):1090-5. 52-Genetic and pharmacological evidence for more than one human steroid 5 alpha-reductase. Jenkins EP, Andersson S, Imperato-McGinley J, Wilson JD, Russell DW. J Clin Invest. 1992 Jan;89(1):293-300. 53-Tissue distribution and ontogeny of steroid 5 alpha-reductase isozyme expression.Thigpen AE, Silver RI, Guileyardo JM, Casey ML, McConnell JD, Russell DW. J Clin Invest. 1993 Aug;92(2):903-10. 54-Characterization, expression, and immunohistochemical localization of 5 alpha-reductase in human skin. Luu-The V, Sugimoto Y, Puy L, Labrie Y, Lopez Solache I, Singh M, Labrie F. J Invest Dermatol. 1994 Feb;102(2):221-6. 55-Steroid 5 alpha-reductase: two genes/two enzymes. Russel DW, Wilson JD. Annu Rev Biochem. 1994;63:25-61. 56-Androgenic correlates of genetic variation in the gene encoding 5alpha-reductase type 1. Ellis JA, Panagiotopoulos S, Akdeniz A, Jerums G, Harrap SB.J Hum Genet. 2005;50(10):534-7. 57-Variants in the 5alpha-reductase type 1 and type 2 genes are associated with polycystic ovary syndrome and the severity of hirsutism in affected women. Goodarzi MO, Shah NA, Antoine HJ, Pall M, Guo X, Azziz R. J Clin Endocrinol Metab. 2006 Oct;91(10):4085-91. 58-Association of genetic variants in the two isoforms of 5α-reductase, SRD5A1 and SRD5A2, in lean patients with polycystic ovary syndrome. Graupp M, Wehr E, Schweighofer N, Pieber TR, Obermayer-Pietsch B. Eur J Obstet Gynecol Reprod Biol. 2011 Aug;157(2):175-9. 59-Heritability of plasma sex hormones and hormone binding globulin in adult male twins. Ring HZ, Lessov CN, Reed T, Marcus R, Holloway L, Swan GE, Carmelli D. J Clin Endocrinol Metab. 2005 Jun;90(6):3653-8. 60-Molecular analyses of a human sex hormone-binding globulin variant: evidence for an additional carbohydrate chain. Power SG, Bocchinfuso WP, Pallesen M, Warmels-Rodenhiser S, Van Baelen H, Hammond GL . J Clin Endocrinol Metab. 1992 Oct;75(4):1066-70. 61-Human sex hormone-binding globulin variants associated with hyperandrogenism and ovarian dysfunction. Hogeveen KN, Cousin P, Pugeat M, Dewailly D, Soudan B, Hammond GL. J Clin Invest. 2002 Apr;109(7):973-81 62-Influence of SHBG gene pentanucleotide TAAAA repeat and D327N polymorphism on serum sex hormone-binding globulin concentration in hirsute women. Cousin P, Calemard-Michel L, Lejeune H, Raverot G, Yessaad N, Emptoz-Bonneton A, Morel Y, Pugeat M.J Clin Endocrinol Metab. 2004 Feb;89(2):917-24 63-Common Variants in the Sex Hormone-Binding Globulin (SHBG) Gene Influence SHBG Levels in Women with Polycystic Ovary Syndrome. Abu-Hijleh TM, Gammoh E, Al-Busaidi AS, Malalla ZH, Madan S, Mahmood N, Almawi WY. Ann Nutr Metab. 2016;68(1):66-74. 64-Association of anthropometric, androgenic and insulin-related features with polymorphisms in exon 8 of SHBG gene in women with polycystic ovary syndrome. Hacıhanefioğlu B, Aybey B, Hakan Özön Y, Berkil H, Karşıdağ K. Gynecol Endocrinol. 2013 Apr;29(4):361-4. 65-Risk of venous thromboembolism in women with polycystic ovary syndrome: a population-based matched cohort analysis. Bird ST, Hartzema AG, Brophy JM, Etminan M, Delaney JA. CMAJ.ç 2013 Feb 5;185(2):E115-20. 66-Combined hormonal contraception and the risk of venous thromboembolism: a guideline. Practice Committee of the American Society for Reproductive Medicine. Fertil Steril. 2017 Jan;107(1):43-51. 67-Different combined oral contraceptives and the risk of venous thrombosis:systematic review and network meta-analysis. Stegeman BH, de Bastos M, Rosendaal FR, van Hylckama Vlieg A, Helmerhorst FM, Stijnen T, Dekkers OM. BMJ. 2013 Sep 12;347:f5298. 68-Pills-related severe adverse events: A case report in Taiwan. Chen CH, Chin HY et al. Taiwan J Obstet Gynecol . 2016 Aug;55(4):588-90. 69-Oral contraceptives and breast cancer risk among younger women. Brinton LA, Daling JR, Liff JM et al. J Nath Cancer Inst. 1995 Jun 7;87(11):827-35. 70-Contemporary Hormonal Contraception and the Risk of Breast Cancer. Mørch LS, Skovlund CW, Hannaford PC, Iversen L, Fielding S, Lidegaard Ø. N Engl J Med. 2017 Dec 7;377(23):2228-2239. 71-Breast cancer and hormonal contraceptives: collaborative reanalysis of individual data on 53 297 women with breast cancer and 100 239 women without breast cancer from 54 epidemiological studies.Collaborative Group on Hormonal Factors in Breast Cancer.Lancet. 1996 Jun 22;347(9017):1713-27. 72-Breast cancer among young U.S. women in relation to oral contraceptive use. White E, Malone KE, Weiss NS, Daling JR. J Natl Cancer Inst. 1994 Apr 6;86(7):505-14. 73-Clinical review: Insulin sensitizers for the treatment of hirsutism: a systematic review and metaanalyses of randomized controlled trials. Cosma M, Swiglo BA, Flynn DN, Kurtz DM, Labella ML, Mullan RJ, Elamin MB, Erwin PJ, Montori VM. J Clin Endocrinol Metab. 2008 Apr;93(4):1135-42.74- Treatment Options for Hirsutism: A Systematic Review and Network Meta- Analysis . Barrionuevo P, Nabhan M, Altayar O, Wang Z, Erwin PJ, Asi N, Martin KA, Murad MH. J Clin Endocrinol Metab. 2018 Apr 1;103(4):1258-1264.
75-The endocrine effects of spironolactone used as an antiandrogen. Young RL, Goldzieher JW, Elkind-Hirsch K. Fertil Steril. 1987 Aug;48(2):223-8. 76-A systematic review of commonly used medical treatments for hirsutism in women. Koulouri O, Conway GS. Clin Endocrinol (Oxf). May;68(5):800-5. 77-Comparison of spironolactone, flutamide, and finasteride efficacy in the treatment of hirsutism: a randomized, double blind, placebo-controlled trial. Moghetti P, Tosi F, Tosti A, Negri C, Misciali C, Perrone F, Caputo M, Muggeo M, Castello R. J Clin Endocrinol Metab. 2000 Jan;85(1):89-94.78-Long term follow-up of patients with polycystic ovarian syndrome after laparoscopic ovarian drilling: clinical outcome. Amer SA, Gopalan V, Li TC, Ledger WL, Cooke ID. Hum Reprod. 2002 Aug;17(8):2035-42.
79-Effects of laparoscopic ovarian drilling on adrenal steroids in polycystic ovary syndrome patients with and without hyperinsulinemia. Saleh A, Morris D, Tan SL, Tulandi T. Fertil Steril. 2001 Mar;75(3):501-4.
80-Success of laparoscopic ovarian wedge resection is related to obesity, lipid profile, and insulin levels. Duleba AJ, Banaszewska B, Spaczynski RZ, Pawelczyk L. Fertil Steril. 2003 Apr;79(4):1008-14.
81-Spironolactone and risk of incident breast cancer in women older than 55 years: retrospective, matched cohort study. Mackenzie IS, Macdonald TM, Thompson A, Morant S, Wei L. BMJ. 2012 Jul 13;345:e4447. 82-Spironolactone use and risk of incident cancers: a retrospective, matched cohort study. Mackenzie IS, Morant SV, Wei L, Thompson AM, MacDonald TM. Br J Clin Pharmacol. 2017 Mar;83(3):653-663. 83-Spironolactone use and the risk of breast and gynecologic cancers. Biggar RJ, Andersen EW, Wohlfahrt J, Melbye M. Cancer Epidemiol. 2013 Dec;37(6):870-5. 84-Adverse Effects and Safety of 5-alpha Reductase Inhibitors (Finasteride, Dutasteride): A Systematic Review. Hirshburg JM, Kelsey PA, Therrien CA, Gavino AC, Reichenberg JS. J Clin Aesthet Dermatol. 2016 Jul;9(7):56-62. 85-Is paradoxical hair growth caused by low-level radiant exposure by home-use laser and intense pulsed light devices? Town G, Bjerring P. J Cosmet Laser Ther. 2016 Oct;18(6):355-62. 86-Paradoxical effect after IPL photoepilation. Moreno-Arias G, Castelo-Branco C, Ferrando J. Dermatol Surg. 2002 Nov;28(11):1013-6; discussion 1016. 87-Paradoxical hypertrichosis after laser therapy: a review. Desai S , Mahmoud BH, Bhatia AC, Hamzavi IH. Dermatol Surg. 2010 Mar;36(3):291-8. 88-Laser hair reduction in the hirsute patient: a critical assessment. Sanchez LA, Perez M, Azziz R. Hum Reprod Update. 2002 Mar-Apr;8(2):169-81. 89-Laser hair removal in women with polycystic ovary syndrome. McGill DJ, Hutchison C, McKenzie E, McSherry E, Mackay IR. J Plast Reconstr Aesthet Surg. 2007;60(4):426-31. 90-Laser-assisted hair removal for facial hirsutism in women: A review of evidence. Lee CM. J Cosmet Laser Ther. 2018 Jun;20(3):140-144.Bunları da İnceleyin;
 Polikistik Over
Polikistik Over